Liệu pháp tế bào T – CAR đã được phê chuẩn để điều trị bệnh Bạch cầu tăng lymphô bào B cấp tính (B-cell acute lymphoblastic leukemia) ở một số đối tượng trẻ em và người trẻ tuổi.
Một hành động lịch sử đã được thông qua bởi cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ – FDA khi liệu pháp gen đầu tiên mang tên Kymriah (tisagenlecleucel) được phê chuẩn vào ngày 30/08/2017 tại quốc gia này, mở ra cách tiếp cận mới đối với việc điều trị ung thư và các bệnh nguy hiểm đe dọa đến mạng sống con người.
Kymriah là liệu pháp gen dựa trên tế bào dùng trong điều trị bệnh nhân dưới 25 tuổi mắc bệnh bạch cầu tăng lymphô bào B ở giai đoạn trơ hoặc giai đoạn tái phát.
Acute lymphoblastic leukemia (ALL – tạm dịch: Bạch cầu tăng lymphô bào cấp tính) là một dạng ung thư máu và tủy xương xảy ra khi cơ thể sản xuất những tế bào bạch cầu bất thường. Bệnh diễn biến rất nhanh và thường gặp ở trẻ nhỏ. Viện nghiên cứu ung thư quốc gia Hoa Kỳ ước tính có gần 3100 bệnh nhân dưới 20 tuổi được chẩn đoán mắc ALL mỗi năm. ALL có nguồn gốc từ tế bào B hoặc T nhưng dạng tế bào B là dạng thường gặp nhất.
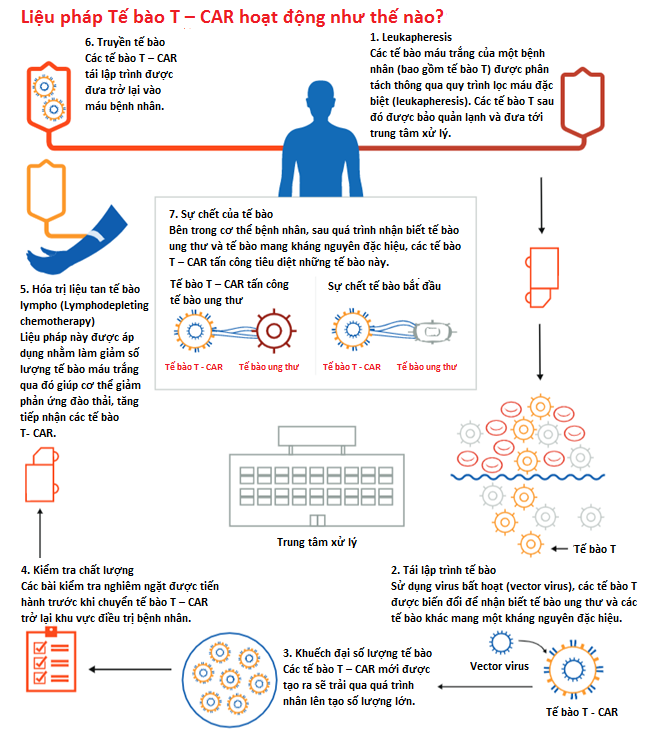
Trong liệu pháp miễn dịch Kymriah, các tế bào T – một dòng tế bào máu trắng (lymphocyte) của từng bệnh nhân được thu thập và gửi đến một trung tâm, tại nơi này chúng sẽ được biến đổi để mang một gen mới mã hóa protein đặc hiệu có tên là CAR (chimeric antigen receptor- tạm dịch: thụ thể kháng nguyên khảm). Các tế bào T – CAR này sau đó sẽ nhắm đích và giết chết các tế bào bạch cầu mang kháng nguyên đặc hiệu CD19 trên bề mặt. Một khi các tế bào được sửa đổi, chúng sẽ được đưa trở lại vào bệnh nhân để tiêu diệt các tế bào ung thư.
Tính an toàn và hiệu quả của Kymriah đã được chứng minh trong một thử nghiệm lâm sàng liên kết giữa nhiều trung tâm. Tình trạng của 63 bệnh nhi và bệnh nhân trẻ tuổi đang trong giai đoạn trơ hoặc giai đoạn tái phát ALL dòng tế bào B được theo dõi sau khi áp dụng liệu pháp Kymriah. Sau ba tháng điều trị, 83% bệnh nhân được báo cáo với tình trạng bệnh thuyên giảm.
Tuy nhiên, điều trị với Kymriah có khả năng gây ra các phản ứng phụ nghiêm trọng. Một trong số đó là hội chứng giải phóng cytokine (CRS – cytokine release syndrome). CRS là đáp ứng hệ thống của cơ thể đối với sự hoạt hóa và gia tăng các tế bào T – CAR gây ra sốt cao và các triệu chứng giống cúm, cảm sốt. Bên cạnh đó, các biến chứng thần kinh cũng thường xuyên xảy ra trong điều trị Kymriah. Hai dạng phản ứng phụ này đều có thể đe doạ đến tính mạng con người. Ngoài ra, các phản ứng phụ nguy hiểm khác bao gồm nhiễm trùng, hạ huyết áp, tổn thương thận cấp tính và giảm ôxy trong máu. Hầu hết các triệu chứng xuất hiện trong vòng 1 đến 22 ngày kể từ khi truyền tế bào T – CAR. Vì kháng nguyên CD19 cũng hiện diện trên các tế bào B khỏe mạnh, và Kymriah cũng tiêu diệt những tế bào B này nên lượng kháng thể tạo ra giảm, do đó làm tăng nguy cơ nhiễm trùng trong một khoảng thời gian dài.
Trong cùng ngày, FDA cũng ra hạn sử dụng Actemra (tocilizumab) trong điều trị CRS ở bệnh nhân từ 2 tuổi trở lên. Trong các thử nghiệm lâm sàng ở bệnh nhân đang điều trị với liệu pháp tế bào T – CAR, 69% bệnh nhân đã chấm dứt các triệu chứng của CRS sau 2 tuần sử dụng một hoặc hai liều Actemra.
Do nguy cơ CRS và các biến chứng thần kinh, một hệ thống mang tên REMS được áp dụng để đánh giá các nguy cơ trong điều trị với Kymriah. Trong đó, FDA yêu cầu các bệnh viện và các phòng khám ứng dụng Kymriah cần có chứng nhận đặc biệt; nhân viên kê toa, phân phát hoặc quản lý Kymriah cần trải qua các khóa đào tạo để nhận biết và xử lý CRS cũng như những biến chứng thần kinh. Ngoài ra, các thiết lập chăm sóc sức khoẻ cần xây dựng quy trình cụ thể để đảm bảo rằng Kymriah chỉ được áp dụng cho bệnh nhân sau khi xác minh chắc chắn rằng tocilizumab có sẵn để sử dụng. Chương trình REMS quy định rằng bệnh nhân phải được thông báo về các dấu hiệu và triệu chứng của CRS và các biến chứng thần kinh cũng như tầm quan trọng của việc trở lại điều trị ngay lập tức nếu họ bị sốt hoặc gặp các phản ứng phụ khác sau khi điều trị với Kymriah.
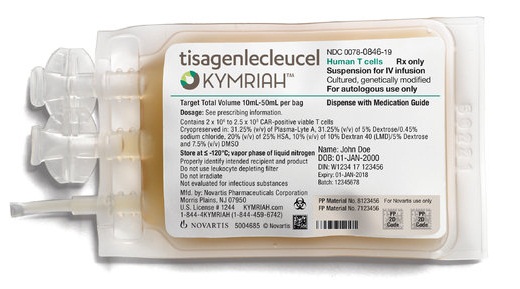
Kymriah hiện có giá thành thương mại là 475,000$, tuy nhiên, theo phát ngôn của công ty sản xuất Novartis, nếu trong vòng 1 tháng, bệnh nhân không đáp ứng với phương pháp điều trị thì sẽ được hoàn tiền. FDA cũng yêu cầu Novartis tiếp tục đánh giá mức độ an toàn dài hạn bằng nghiên cứu giám sát ở số lượng lớn bệnh nhân điều trị với Kymriah.
Tài liệu tham khảo:
“FDA approval brings first gene therapy to the United States“, FDA, August 30, 2017.
Theo Biomedia Việt Nam





