Ho Huu Tho
Senior Member
#8.13
The Cellular Environment Affects Enzyme Activity
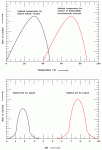
Temperature and pH. Enzymes are sensitive to their environmental conditions. Up to a point, the rate of the reaction will increase as a function of temperature because the substrates will collide more frequently with the enzyme active site. At extremes of pH or temperature, either high or low, the native structure of the enzyme will be compromised, and the molecule will become inactive (see Figure 3). Note that there is a sharp decrease in the temperature optimum for typical human enzymes at approximately 40 degrees Celsius (104 degrees Fahrenheit). At temperatures greater than 40 degrees Celsius, the enzyme degrades because the noncovalent interactions that stabilize the native conformation of the enzyme are disrupted. The enzyme in essence falls apart, and the active site is no longer able to function. In contrast, the optimal temperature for enzymes of the thermophilic bacteria (extremophiles) that live in hot springs is quite high at 70 degrees Celsius (158 degrees Fahrenheit), a temperature that would instantly scald skin.
Môi trường tế bào ảnh hưởng đến hoạt tính của enzym
Nhiệt độ và pH: Các enzym nhạy cảm với các điều kiện môi trường. Đến một giới hạn nhất định, tốc độ của phản ứng sẽ tăng theo hàm của nhiệt độ vì các cơ chất sẽ va chạm nhau thường xuyên hơn tại vùng hoạt động của enzym. Tại điểm tới hạn của pH và nhiệt độ, dù là cao hay thấp, cấu trúc tự nhiên của enzym sẽ bị biến đổi và phân tử sẽ bị bất hoạt (xem hình 3). Lưu ý là có sự giảm đột ngột tại nhiệt độ tối ưu cho các enzym đặc trưng của con người là khoảng 40 độ C. Khi nhiệt độ trên 40 độ C, enzym thoái biến vì các tương tác không hoá trị có chức năng ổn định cấu hình tự nhiên của enzym bị phá vỡ. Đặc tính căn bản của enzym biến mất và vùng hoạt động không thể hoạt động được nữa. Ngược lại, nhiệt độ tối ưu của các enzym ở các vi khuẩn ái nhiệt sống tại những suối nước nóng lại tương đối cao khoảng 70 độ C, nhiệt độ này có thể gây bỏng da ngay lập tức.