Tế bào gốc (TBG) hiện nay là công nghệ y học tiên tiến nhất, song cũng đang gây nên những tranh luận và chia rẽ sâu rộng trong ứng dụng trị liệu. Bài viết phân tích về các xu hướng phát triển của trị liệu TBG, từ đó đề xuất định hướng phát triển nghiên cứu và ứng dụng TBG ở Việt Nam.
Xu thế phát triển trị liệu của tế bào gốc
TBG là mầm của sự sống và là một tập thể đa dạng hiện diện ngay từ khi phôi được hình thành (gồm TBG phôi, TBG thai nhi), trong tiến trình sinh sản (TBG cuống rốn), và ở mọi cơ quan khi trưởng thành (TBG tuỷ, răng, da, tim, tuỵ, thần kinh v.v.). Số lượng và chức năng của TBG giảm dần theo tuổi thọ và đóng vai trò quyết định trong tiến trình lão hoá và chết. Giá trị trị liệu của TBG được dựa theo tính biệt hoá nhiều hay ít của các loại tế bào. Theo đó, TBG toàn năng và đa năng lấy từ các tế bào đầu tiên của phôi và có thể biệt hoá thành tất cả trên 200 loại tế bào của cơ thể; TBG đơn năng lấy từ các cơ quan chỉ có thể biệt hoá thành loại tế bào của cơ quan đó. Tuy nhiên, với kỹ thuật hiện đại, các TBG đơn năng cũng có thể được biệt hoá thành rất nhiều loại tế bào khác; chẳng hạn, TBG trung mô (TBG-TM hay MSC, Mesenchymal Stem Cell) ngoài khả năng biệt hoá thành tế bào sụn, xương, cũng có thể được biệt hoá trong điều kiện thí nghiệm thành tế bào thần kinh, tim. TBG cũng có liên hệ mật thiết đến các bệnh do sự tăng hoặc giảm số lượng hoặc do đột biến như TBG ung thư, hiện được coi là nguồn gốc của ung thư và là đối tượng rất quan trọng cho nghiên cứu và trị liệu các bệnh này.
Gần đây, nghiên cứu TBG đã có bước tiến đột phá khi chuyển thành công các gene đặc hiệu (Oct4, Sox2, cMyc và Klf4) vào tế bào da để biệt hoá thành TBG toàn năng hay đa năng (iPS) trong phòng thí nghiện trong thời gian ngắn (4 tuần), có tiềm năng ứng dụng rất rộng lớn trong y học (Hình 1). Thành quả này đã được trao tặng giải Nobel y học năm 2012. Tương tự, có thể chuyển đổi tế bào da thành các tế bào có chức năng phúc tạp hơn như mạch máu hay thần kinh. Ước tính sẽ có thêm nhiều loại TBG được khám phá chẳng hạn như TBG rất nhỏ giống tế bào phôi (VSELs, very small like embryonic stem cell- Mariusz Ratajczak, Hoa kỳ) hay tế bào biệt hoá vạn năng (endogenous pluripotent stem cell hay ePS – Thea D. Tlsty, ĐH UCSF) được tìm thấy từ nhũ mô. Đặc điểm của các tế bào này là có tính toàn năng như TBG phôi, nhưng không tăng sinh vô hạn giúp giảm thiểu khả năng gây ung bướu.
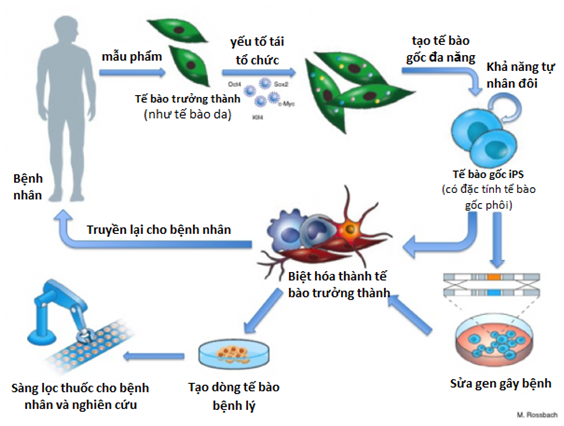 Hình 1. iPS có thể được tạo từ tế bào da của người bệnh để nghiên cứu bệnh lý và tìm thuốc mới cho điều trị.Công nghệ chuyển gene vào các TBG cũng đang tạo ra các dòng TBG mới với tiềm năng trị liệu cao và chuyên biệt. Trong đó có TBG chuyển gen thụ thể tế bào T (CAR-T) dùng trị bệnh ung thư, gene ANP (artrial naturetic protein) trị nhồi máu cơ tim.
Hình 1. iPS có thể được tạo từ tế bào da của người bệnh để nghiên cứu bệnh lý và tìm thuốc mới cho điều trị.Công nghệ chuyển gene vào các TBG cũng đang tạo ra các dòng TBG mới với tiềm năng trị liệu cao và chuyên biệt. Trong đó có TBG chuyển gen thụ thể tế bào T (CAR-T) dùng trị bệnh ung thư, gene ANP (artrial naturetic protein) trị nhồi máu cơ tim.
Đặc biệt với kỹ thuật chỉnh sửa hệ gen CRISPR, các dòng TBG của nhiều loại bệnh liên quan đến di truyền, ung thư, tự nhiễm sẽ được tạo ra để dùng cho nghiên cứu và trị liệu. Hiện nay một số dòng TBG thuộc các bệnh di truyền do đơn gene (monogenic diseases) như bệnh hồng cầu Thalassemia do Hgb, thoái hoá cơ bắp (Duchenne muscular dystrophy (DMD) do dystrophin), miễn nhiễm SCID (do gene adenosine deamilase (ADA) đột biến)… đang được nghiên cứu. Hầu hết những TBG trên đang được dùng trong các thử nghiệm lâm sàng ở các trung tâm nghiên cứu trên thế giới để đánh giá khả năng trị liệu cho các bệnh lý. Dự đoán có gần 100 loại bệnh từ thẩm mỹ, biến dưỡng, tự nhiễm và ung thư có thể được trị liệu bằng TBG. Trong xu hướng phát triển mạnh mẽ này, ứng dụng trị liệu TBG đang được tạm chia thành 2 luồng “chính thống” và “không chính thống”.
Trị liệu dùng TBG “chính thống”
Hiện có hai cơ quan quốc tế chế tài các luật về TBG gồm Cơ quan Thực phẩm và Dược phẩm Hoa Kỳ (FDA) và Cơ quan Y tế Châu Âu (EMEA). FDA và EMEA còn quản lý tất cả các sản phẩm làm từ TBG hay phủ tạng người (HCT/Ps).
Dù có rất nhiều tiềm năng ứng dụng, nhưng theo định nghĩa của FDA/EMEA, các TBG được xếp vào tiêu chuẩn “dược phẩm”, cho nên mọi ứng dụng của TBG cần phải thông qua những nghiên cứu và thử nghiệm lâm sàng nghiêm ngặt. Trên thực tế, việc đánh giá, chế biến và bảo quản TBG còn phức tạp và tốn kém hơn rất nhiều so với thuốc hoá dược, do những nguyên nhân chính sau:
 Hình 2. Sơ đồ mô phỏng từ ly trích, sản xuất đến ứng dụng TBG cho trị liệu.Từ các điều khoản cần khắc phục và hoàn chỉnh nêu trên, dù đã tốn phí hàng nhiều tỷ đô la ở những trung tâm hàng đầu thế giới, hiện chỉ có rất hiếm sản phẩm TBG được cho phép sử dụng. Các sản phẩm chỉ được giới hạn cấp phép cho TBG máu, tuỷ, cuống rốn và mô mỡ. Bảng dưới đây liệt kê 8 sản phẩm TBG được các cơ quan y tế của những nước phát triển cấp phép cho đến năm vừa qua. Những sản phẩm này đều có giá trị kinh tế rất cao, như Prochymal được Công ty Mesoblast, Úc mua lại từ chủ xưởng Osiris, Hoa kỳ với giá 100 triệu đô la; để cạnh tranh, MediPost, Hàn quốc sản xuất TBG-TM cuống rốn có khả năng trị nhiều loại bệnh gồm xương khớp, thần kinh, tiểu đường có trị giá trên 500 triệu đô la.
Hình 2. Sơ đồ mô phỏng từ ly trích, sản xuất đến ứng dụng TBG cho trị liệu.Từ các điều khoản cần khắc phục và hoàn chỉnh nêu trên, dù đã tốn phí hàng nhiều tỷ đô la ở những trung tâm hàng đầu thế giới, hiện chỉ có rất hiếm sản phẩm TBG được cho phép sử dụng. Các sản phẩm chỉ được giới hạn cấp phép cho TBG máu, tuỷ, cuống rốn và mô mỡ. Bảng dưới đây liệt kê 8 sản phẩm TBG được các cơ quan y tế của những nước phát triển cấp phép cho đến năm vừa qua. Những sản phẩm này đều có giá trị kinh tế rất cao, như Prochymal được Công ty Mesoblast, Úc mua lại từ chủ xưởng Osiris, Hoa kỳ với giá 100 triệu đô la; để cạnh tranh, MediPost, Hàn quốc sản xuất TBG-TM cuống rốn có khả năng trị nhiều loại bệnh gồm xương khớp, thần kinh, tiểu đường có trị giá trên 500 triệu đô la.
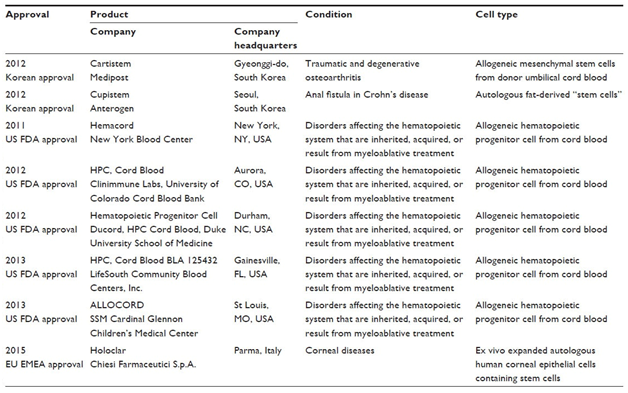 Bảng liệt kê 8 sản phẩm TBG (cho tới năm 2015) đạt tiêu chuẩn “dược phẩm” và được cấp giấy phép của cơ quan y tế quốc gia Hoa Kỳ, Hàn quốc và Ý. Các sản phẩm này hiện đang được kinh doanh và sử dụng ở một số nước trên thế giới.Trị liệu dùng TBG “không chính thống”
Bảng liệt kê 8 sản phẩm TBG (cho tới năm 2015) đạt tiêu chuẩn “dược phẩm” và được cấp giấy phép của cơ quan y tế quốc gia Hoa Kỳ, Hàn quốc và Ý. Các sản phẩm này hiện đang được kinh doanh và sử dụng ở một số nước trên thế giới.Trị liệu dùng TBG “không chính thống”
Xin xác định “không chính thống” không có nghĩa là bất hợp pháp, mà chỉ là những ứng dụng TBG ở ngoài luồng giám sát và chứng nhận của FDA và EMEA. Trên thực tế, việc sử dụng TBG trong trị liệu đã có từ rất lâu trước khi có công nghệ TBG phôi, mô mỡ hay iPS ra đời. Tuy nhiên, các ứng dụng chỉ giới hạn trong việc truyền TBG tuỷ sống, hoặc gián tiếp như máu hay máu cuống rốn. Các ứng dụng TBG này được coi là những “dịch vụ y tế” ở các bệnh viện và được phép thực hiện vì tuân theo quy định của FDA và nhiều cơ quan y tế thế giới cho phép đó là “thao tác tối thiểu và không làm thay đổi cấu trúc tế bào”.
Với đà phát triển nhanh, trong thời gian gần đây TBG dùng để trị liệu được chọn từ các nguồn khác nhau mô mỡ, dây rốn, tủy, máu ngoại vi… thuộc dòng TBG-TM. Những nghiên cứu cho thấy số lượng TBG-TM trong mô mỡ rất dồi dào và cao hàng trăm lần so với tuỷ hoặc giây máu cuống rốn, ngoài ra việc ly trích đơn giản nên chúng trở thành nguồn thông dụng nhất hiện nay.
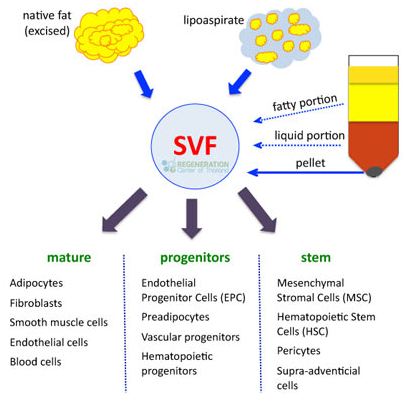 Hình 3. SVF từ mô mỡ là nguồn cung cấp dồi dào TBG TMTrong những năm gần đây, nghiên cứu về TBG-TM gia tăng mạnh và có số lượng đăng tải nhiều nhất so với các loại TBG khác. Đặc điểm sinh học chính có thể tóm lược cho TBG-TM là: đa chức năng, an toàn, không tạo ung bướu và biểu hiệu HLA rất thấp nên thường không gây phản ứng miễn dịch; tính kháng viêm rất mạnh (có khả năng ức chế các tế bào miễn dịch chủ yếu như tế bào T, B, tế bào tua, đại thực bào và tế bào sát thủ NK – Hình 4); tính tăng trưởng tế bào, chống chu trình chết, chống lão hoá và nhiễm trùng. Như vậy, về bản chất, TBG-TM có những đặc tính trị liệu của một loại thuốc hơn là tế bào tái tạo (Hình 5). Vì đặc tính dược liệu này, TBG-TM đã được chuyên gia đầu ngành Arnold Caplan (Đại học Case Western, Mỹ) gọi là tế bào thuốc (Medicinal Signaling Cell).
Hình 3. SVF từ mô mỡ là nguồn cung cấp dồi dào TBG TMTrong những năm gần đây, nghiên cứu về TBG-TM gia tăng mạnh và có số lượng đăng tải nhiều nhất so với các loại TBG khác. Đặc điểm sinh học chính có thể tóm lược cho TBG-TM là: đa chức năng, an toàn, không tạo ung bướu và biểu hiệu HLA rất thấp nên thường không gây phản ứng miễn dịch; tính kháng viêm rất mạnh (có khả năng ức chế các tế bào miễn dịch chủ yếu như tế bào T, B, tế bào tua, đại thực bào và tế bào sát thủ NK – Hình 4); tính tăng trưởng tế bào, chống chu trình chết, chống lão hoá và nhiễm trùng. Như vậy, về bản chất, TBG-TM có những đặc tính trị liệu của một loại thuốc hơn là tế bào tái tạo (Hình 5). Vì đặc tính dược liệu này, TBG-TM đã được chuyên gia đầu ngành Arnold Caplan (Đại học Case Western, Mỹ) gọi là tế bào thuốc (Medicinal Signaling Cell).
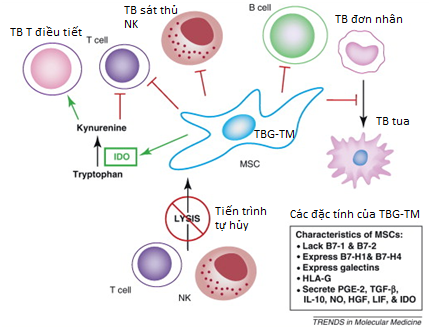 Hình 4. Cơ chế chống viêm của TBG-TM.
Hình 4. Cơ chế chống viêm của TBG-TM.
 Hình 5. TBG-TM là loại “thuốc” có thể dùng cho nhiều ứng dụng trị liệu.Các phương pháp dùng TBG không chính thống trên đang được thực hiện ở rất nhiều nơi trên thế giới, kể cả Mỹ (ước tính có gần 200 phòng mạch hay cơ sở dùng TBG trị liệu cho bệnh nhân ở nhiều tiểu bang). So với phương pháp truyền thống, đương nhiên các TBG này còn rất nhiều thiếu sót. Gần đây FDA đã siết chặt hơn các tiêu chí về “thao tác tối thiểu” cho TBG và đã thêm nhiều giới hạn với những trung tâm trị liệu TBG không chính thống. Ngoài FDA, nhiều trung tâm TBG đầu ngành như ISSCR (International Society for Stem Cell Research), ISCT (the International Society for Cell Therapy), NCBI (National Center for Biotechnology Ingormation) thường lên tiếng cảnh báo về độ an toàn và tai nạn của những trị liệu TBG ngoài luồng. Tuy nhiên, tiếng nói đấu tranh cho ứng dụng TBG cũng gia tăng với sự tham gia của các tổ chức uy tín như ARM (Alliance for Regenerative Medicine), AACT (Alliance for the Advanced Cellular Therapy).
Hình 5. TBG-TM là loại “thuốc” có thể dùng cho nhiều ứng dụng trị liệu.Các phương pháp dùng TBG không chính thống trên đang được thực hiện ở rất nhiều nơi trên thế giới, kể cả Mỹ (ước tính có gần 200 phòng mạch hay cơ sở dùng TBG trị liệu cho bệnh nhân ở nhiều tiểu bang). So với phương pháp truyền thống, đương nhiên các TBG này còn rất nhiều thiếu sót. Gần đây FDA đã siết chặt hơn các tiêu chí về “thao tác tối thiểu” cho TBG và đã thêm nhiều giới hạn với những trung tâm trị liệu TBG không chính thống. Ngoài FDA, nhiều trung tâm TBG đầu ngành như ISSCR (International Society for Stem Cell Research), ISCT (the International Society for Cell Therapy), NCBI (National Center for Biotechnology Ingormation) thường lên tiếng cảnh báo về độ an toàn và tai nạn của những trị liệu TBG ngoài luồng. Tuy nhiên, tiếng nói đấu tranh cho ứng dụng TBG cũng gia tăng với sự tham gia của các tổ chức uy tín như ARM (Alliance for Regenerative Medicine), AACT (Alliance for the Advanced Cellular Therapy).
Trên thực tế có khoảng gần 1 triệu người Mỹ chọn trị liệu bằng TBG qua những chương trình du lịch y tế tới các nước Nam Mỹ như Mêhicô, Chilê, hay châu Á như Ấn Độ, Trung Quốc, Singapore, Malaysia, Thái Lan, Philippin. Ở nhiều quốc gia, du lịch y tế dùng TBG đang là một ngành kinh doanh có doanh thu hàng tỷ USD. Và nó càng trở nên hấp dẫn khi ngày càng có nhiều những nhân chứng xác thực về hiệu quả trị liệu như phép màu của TBG đối với những căn bệnh nan y. Một chi tiết đặc biệt cần được lưu ý là, đã có rất nhiều công nghệ y sinh tiên tiến được ứng dụng trong các thập niên vừa qua như kháng thể đơn dòng; trị liệu gene; vacxin trị ung thư; tế bào miễn dịch như tế bào tua, tế bào T, NK… nhưng chưa có công nghệ nào được dùng trị liệu ngoài luồng phổ biến và nhiều nơi như TBG. Công bằng mà nói thì tất cả mọi loại thuốc và trị liệu đều có thể gây phản ứng phụ từ không nguy hiểm cho đến nguy hiểm. Trị liệu TBG tự thân thường được quảng bá là an toàn, do đó có thể tạo niềm tin là dùng trị liệu TBG nếu không khỏi bệnh thì cũng chẳng có phản ứng bất lợi nào đối với bệnh nhân. Đây là quan điểm sai lầm. Như trên đã phân tích, tự bản chất TBG rất phức tạp nên bất cứ một thao tác nào cũng có thể gây phản ứng với cơ thể và mang lại hậu quả khó lường. Tuy nhiên, với những gì đang diễn ra, chúng ta cần thẩm định TBG theo nhận định thực tiễn, và công bằng hơn là theo những phê phán kinh điển, tháp ngà để từ đó xây dựng nên những ứng dụng TBG an toàn, đem lại lợi ích thiết thực cho nhu cầu sức khỏe của đại chúng.
Việt Nam cần làm gì?
TBG là khoa học của thế kỷ và của tương lai. Việt Nam có thể dựa vào công nghệ TBG làm mũi nhọn nâng khoa học trong nước lên cao hơn trên trường quốc tế. Chiều hướng này đang được thực hiện ở một số cơ sở y tế và chương trình nghiên cứu ở trong nước như Bệnh viện Huyết học và Truyền máu TP Hồ Chí Minh, Bệnh viện Vạn Hạnh (TP Hồ Chí Minh), Trung tâm Vinmec (Hà Nội), Phòng thí nghiệm nghiên cứu và ứng dụng TBG (Đại học Quốc gia TP Hồ Chí Minh)… Trong vòng hai năm gần đây, các bệnh viện và trung tâm khoa học lớn ở Việt Nam đều có hoặc đang xây dựng đơn vị TBG cho nghiên cứu và trị liệu. Mặc dù vậy, đánh giá chung cho thấy, số chuyên gia công nghệ TBG của Việt Nam rất thiếu so với nhu cầu, và các hoạt động nghiên cứu còn ở mức độ nhỏ lẻ. Nhìn về tương lai, Việt Nam cần quan tâm tới một số vấn đề sau:
1) TBG là một khoa học đa ngành nên cần một trung tâm đa khoa để có thể khai triển hữu hiệu và toàn diện công nghệ TBG. Trung tâm này cần có các nhóm giải trình tự gene/genome, phân tích protein/proteonomic để xác định chức năng gene; nhóm sinh tin học để hiểu sâu rộng các thông tin về gene và tác động trên tế bào; nhóm miễn dịch học để thiết kế an toàn và đánh giá hiệu năng của TBG; nhóm vật liệu sinh học để tạo sản phẩm ứng dụng cho TBG; nhóm sinh lý động vật cho đánh giá chức năng TBG trên động vật. Nếu điều kiện chưa cho phép, kế hoạch mở rộng liên kết với nhiều trung tâm trong và ngoài nước là rất cần thiết. Nói chung, mục tiêu cuối cùng là chúng ta có khả năng phân loại các dòng TBG qua cấu trúc genome, giải thích chức năng của TBG bằng cơ chế phân tử, vì đó là giải đáp chính xác và quan trọng cần có cho nghiên cứu TBG hiện đại.
2) Cần tổ chức và xây dựng công nghệ TBG thành một bộ phận thiết yếu của ngành y vì các bác sỹ và chuyên gia y tế chính là những người trực tiếp sử dụng TBG trên bệnh nhân và họ cũng chịu trách nhiệm trong công tác tổ chức, giải quyết hậu quả. Theo nghĩa này, chương trình chuyên ngành Translational medicine, với chức năng ứng dụng các kết quả nghiên cứu TBG ở các phòng thí nghiệm cho người bệnh của các trung tâm y tế là thiết yếu. Ở nhiều trường y khoa trên thế giới, ngoài những nghiên cứu cơ bản, đều có ngành Translational medicine để thực hiện mục đích này.
3) Tận dụng ưu thế bệnh lý, môi trường ở Việt Nam để tạo các dòng iPS sử dụng trong nghiên cứu và trị liệu. Thực tế chúng ta có thể tạo ngân hàng iPS cho rất nhiều bệnh lý từ các bệnh nhân và dùng đánh giá nguyên nhân gây bệnh, hiệu năng trị liệu hay tính kháng thuốc để từ đó tìm ra những phương thức trị liệu hữu hiệu và mới mẻ. Chẳng hạn ở Việt Nam đã có rất nhiều bệnh do phơi nhiễm chất độc da cam/dioxin, việc tạo dòng iPS của những bệnh nhân này sẽ giúp thực hiện nhiều nghiên cứu quan trọng, có giá trị kinh tế cao, vì nhiều hãng dược phẩm trên thế giới rất cần các nghiên cứu chuyên sâu để tìm hiểu vai trò của dioxin đối với chức năng và bệnh lý của hệ miễn dịch. Ngoài ra, các vấn đề môi trường ở Việt Nam hiện đang gây một số bệnh có tính kháng thuốc cao, iPS tạo từ những loại bệnh này sẽ có giá trị quan trọng cho nghiên cứu cơ chế và tìm thuốc mới không riêng cho các nhà nghiên cứu trong nước mà còn cho cả những chương trình quốc tế. Nghiên cứu các chủ đề y tế trên người Việt là một trách nhiệm tinh thần và khoa học. Trên thực tế, các chương trình như vậy còn có giá trị chiến lược để tránh các đề tài chung chung mà chúng ta lặp lại và dễ bị đánh giá thấp so với những nước tiên tiến.
4) Cần triển khai TBG chuyển gen trong các nghiên cứu trị liệu mới, tuy nhiên chúng ta sẽ khó đi sâu vào công nghệ này trong sản xuất vì việc tạo dòng, duy trì và sản xuất tốn kém hơn nhiều so với lấy từ bệnh nhân. Thay vào đó, chúng ta đầu tư cải tiến kỹ thuật cho các nguồn TBG đang được ứng dụng như TBG mô mỡ, các nguồn TBG cuống rốn, máu để thu hoạch TBG-TM chất lượng, nâng cấp các phương tiện bảo tồn, quản lý có tiêu chuẩn an toàn cao; ngoài ra các nguồn TBG có hiệu năng trị liệu cao cần được tạo thành dòng tế bào chủ, đánh giá và lưu giữ lâu dài để ứng dụng cho một tập thể rộng lớn.
5) Vì tinh tuý khoa học TBG được phát triển ở các nước tiên tiến, chúng ta cần có một chiến lược hợp tác quốc tế trọng tâm, tạo điều kiện hợp tác qua các hội nghị chuyên ngành, phổ biến thành tựu với cơ quan nước ngoài. Đây là một thử thách không nhỏ vì sự cách biệt về khả năng khoa học và khác biệt về văn hoá. Do đó, việc thu hút các chuyên gia Việt Nam ở nước ngoài có tài và tâm huyết là một kế hoạch cần thiết để rút ngắn khoảng cách hiện đại hoá công nghệ quan trọng này.
6) Về điều hành, cần có sự liên hệ mật thiết hơn giữa các trung tâm nghiên cứu và chính quyền để giảm thiểu rào cản pháp lý cho những ứng dụng khả thi và quan trọng. Vì bản chất xã hội của TBG rất cao, việc thành lập các hiệp hội TBG cấp thành phố, tỉnh sẽ giúp tạo sự tham gia sáng suốt của những bệnh nhân và tránh sự phát triển thiếu tiêu chuẩn ở các địa phương.
7) Điểm cuối cùng và có lẽ quan trọng nhất là cần những kế hoạch mạnh mẽ đầu tư từ Chính phủ và tư nhân. Việc đầu tư một số chương trình trọng điểm, thay vì dàn trải, cho nghiên cứu TBG là rất cần thiết và hợp lý trong hoàn cảnh thiếu chuyên gia và nhân lực như Việt Nam. Ở nước ngoài, các nguồn tài trợ được phân bổ rất hợp lý. Các cơ quan tài trợ chính phủ như NIH (National Institute of Health), NSF (National Science Foundation), CDC (Center for Disease Control), DOD (Department of Defense) được dành cho phát triển nghiên cứu cơ bản. Các hãng dược thường tham gia vào các nghiên cứu tiềm năng ở các đại học. Khi có thành quả thì họ đầu tư kinh phí rất nhiều để đẩy mạnh và đi nhanh đến sản xuất. Các hãng dược cung cấp khoảng 60% kinh phí ở các đại học vì họ biết lợi nhuận thu lại sẽ là gấp bội. Họ có tầm nhìn và chiến lược rất hữu hiệu cho đầu tư công nghệ sinh học. Rất mong trong thời gian tới, các hãng dược trong nước sẽ đầu tư mạnh hơn vào công nghệ TBG. Như vậy, nếu chúng ta phát triển mạnh mẽ nghiên cứu TBG ở các trường đại học, trung tâm nghiên cứu trong nước; áp dụng và xử lý tốt, an toàn ở các bệnh viện; tiếp cận rộng rãi các chương trình nghiên cứu hiện đại trên thế giới, thì chúng ta có thể chuyển đổi trị liệu TBG “không chính thống” thành “chính thống” và tiến tới những thành quả to lớn, quan trọng cho công nghệ TBG trong y tế và khoa học Việt Nam.
Tài liệu tham khảo
(các tài liệu dưới đây có tính gợi ý cho một số khía cạnh của bài viết này)
Về tổ chức, phát triển và an toàn của trị liêu TBG:
More...
Xu thế phát triển trị liệu của tế bào gốc
TBG là mầm của sự sống và là một tập thể đa dạng hiện diện ngay từ khi phôi được hình thành (gồm TBG phôi, TBG thai nhi), trong tiến trình sinh sản (TBG cuống rốn), và ở mọi cơ quan khi trưởng thành (TBG tuỷ, răng, da, tim, tuỵ, thần kinh v.v.). Số lượng và chức năng của TBG giảm dần theo tuổi thọ và đóng vai trò quyết định trong tiến trình lão hoá và chết. Giá trị trị liệu của TBG được dựa theo tính biệt hoá nhiều hay ít của các loại tế bào. Theo đó, TBG toàn năng và đa năng lấy từ các tế bào đầu tiên của phôi và có thể biệt hoá thành tất cả trên 200 loại tế bào của cơ thể; TBG đơn năng lấy từ các cơ quan chỉ có thể biệt hoá thành loại tế bào của cơ quan đó. Tuy nhiên, với kỹ thuật hiện đại, các TBG đơn năng cũng có thể được biệt hoá thành rất nhiều loại tế bào khác; chẳng hạn, TBG trung mô (TBG-TM hay MSC, Mesenchymal Stem Cell) ngoài khả năng biệt hoá thành tế bào sụn, xương, cũng có thể được biệt hoá trong điều kiện thí nghiệm thành tế bào thần kinh, tim. TBG cũng có liên hệ mật thiết đến các bệnh do sự tăng hoặc giảm số lượng hoặc do đột biến như TBG ung thư, hiện được coi là nguồn gốc của ung thư và là đối tượng rất quan trọng cho nghiên cứu và trị liệu các bệnh này.
Gần đây, nghiên cứu TBG đã có bước tiến đột phá khi chuyển thành công các gene đặc hiệu (Oct4, Sox2, cMyc và Klf4) vào tế bào da để biệt hoá thành TBG toàn năng hay đa năng (iPS) trong phòng thí nghiện trong thời gian ngắn (4 tuần), có tiềm năng ứng dụng rất rộng lớn trong y học (Hình 1). Thành quả này đã được trao tặng giải Nobel y học năm 2012. Tương tự, có thể chuyển đổi tế bào da thành các tế bào có chức năng phúc tạp hơn như mạch máu hay thần kinh. Ước tính sẽ có thêm nhiều loại TBG được khám phá chẳng hạn như TBG rất nhỏ giống tế bào phôi (VSELs, very small like embryonic stem cell- Mariusz Ratajczak, Hoa kỳ) hay tế bào biệt hoá vạn năng (endogenous pluripotent stem cell hay ePS – Thea D. Tlsty, ĐH UCSF) được tìm thấy từ nhũ mô. Đặc điểm của các tế bào này là có tính toàn năng như TBG phôi, nhưng không tăng sinh vô hạn giúp giảm thiểu khả năng gây ung bướu.

Đặc biệt với kỹ thuật chỉnh sửa hệ gen CRISPR, các dòng TBG của nhiều loại bệnh liên quan đến di truyền, ung thư, tự nhiễm sẽ được tạo ra để dùng cho nghiên cứu và trị liệu. Hiện nay một số dòng TBG thuộc các bệnh di truyền do đơn gene (monogenic diseases) như bệnh hồng cầu Thalassemia do Hgb, thoái hoá cơ bắp (Duchenne muscular dystrophy (DMD) do dystrophin), miễn nhiễm SCID (do gene adenosine deamilase (ADA) đột biến)… đang được nghiên cứu. Hầu hết những TBG trên đang được dùng trong các thử nghiệm lâm sàng ở các trung tâm nghiên cứu trên thế giới để đánh giá khả năng trị liệu cho các bệnh lý. Dự đoán có gần 100 loại bệnh từ thẩm mỹ, biến dưỡng, tự nhiễm và ung thư có thể được trị liệu bằng TBG. Trong xu hướng phát triển mạnh mẽ này, ứng dụng trị liệu TBG đang được tạm chia thành 2 luồng “chính thống” và “không chính thống”.
Trị liệu dùng TBG “chính thống”
Hiện có hai cơ quan quốc tế chế tài các luật về TBG gồm Cơ quan Thực phẩm và Dược phẩm Hoa Kỳ (FDA) và Cơ quan Y tế Châu Âu (EMEA). FDA và EMEA còn quản lý tất cả các sản phẩm làm từ TBG hay phủ tạng người (HCT/Ps).
Dù có rất nhiều tiềm năng ứng dụng, nhưng theo định nghĩa của FDA/EMEA, các TBG được xếp vào tiêu chuẩn “dược phẩm”, cho nên mọi ứng dụng của TBG cần phải thông qua những nghiên cứu và thử nghiệm lâm sàng nghiêm ngặt. Trên thực tế, việc đánh giá, chế biến và bảo quản TBG còn phức tạp và tốn kém hơn rất nhiều so với thuốc hoá dược, do những nguyên nhân chính sau:
- TBG rất khó kiểm soát, điều chỉnh liều lượng như các hoá chất, hay các hợp chất sinh học như protein, kháng thể đơn dòng, gene trị liệu. Đặc biệt là trong khi thuốc, protein, gene bị đào thải, thì TBG có thể tồn tại trong cơ thể rất lâu và tham gia với các hệ thống sinh học của cơ thể. Điều này có thể gây hiệu ứng bất lợi như phản ứng viêm mãn tính, đào thải hoặc có thể là ung thư trong một số trường hợp dùng TBG phôi. Kể cả iPS dù được coi là công nghệ đột phá của TBG hiện nay, vẫn có rất nhiều trở ngại cần được khắc phục.
- Trên lý thuyết, TBG có thể biệt hoá thành các tế bào chức năng dùng trong trị liệu của công nghệ tái tạo. Nhưng trong thực tế, đây là tiến trình phức tạp và rất tốn kém vì thường cần một số lượng tế bào khá lớn (vài chục hay hàng trăm triệu) cho các lần trị liệu. Trong rất nhiều trường hợp, với số lượng lớn như vậy, tế bào sẽ biệt hoá không hoàn toàn, tạo thành quần thể tế bào không đồng dạng, đồng chức năng. Ngoài ra, TBG còn có thể bị lẫn trong hỗn hợp tế bào biệt hoá, tạo ra những hệ quả khó lường, đặc biệt là trong trường hợp dùng TBG phôi.
- Dù các kết quả ly trích và biệt hoá TBG thành công, việc bảo quản, di chuyển, xử lý cho trị liệu còn cần được bảo đảm độ an toàn không lây nhiễm, chức năng tế bào không bị thay đổi, đều đòi hỏi những kỹ năng chuyên môn cao và tuân thủ các tiêu chuẩn của FDA hoặc EMEA. Cho tới nay đã có trên 5000 thử nghiệm lâm sàng TBG trên thế giới, và phần lớn trên 80% những thử nghiệm này còn ở giai đoạn đầu (pha I và II).


Xin xác định “không chính thống” không có nghĩa là bất hợp pháp, mà chỉ là những ứng dụng TBG ở ngoài luồng giám sát và chứng nhận của FDA và EMEA. Trên thực tế, việc sử dụng TBG trong trị liệu đã có từ rất lâu trước khi có công nghệ TBG phôi, mô mỡ hay iPS ra đời. Tuy nhiên, các ứng dụng chỉ giới hạn trong việc truyền TBG tuỷ sống, hoặc gián tiếp như máu hay máu cuống rốn. Các ứng dụng TBG này được coi là những “dịch vụ y tế” ở các bệnh viện và được phép thực hiện vì tuân theo quy định của FDA và nhiều cơ quan y tế thế giới cho phép đó là “thao tác tối thiểu và không làm thay đổi cấu trúc tế bào”.
Với đà phát triển nhanh, trong thời gian gần đây TBG dùng để trị liệu được chọn từ các nguồn khác nhau mô mỡ, dây rốn, tủy, máu ngoại vi… thuộc dòng TBG-TM. Những nghiên cứu cho thấy số lượng TBG-TM trong mô mỡ rất dồi dào và cao hàng trăm lần so với tuỷ hoặc giây máu cuống rốn, ngoài ra việc ly trích đơn giản nên chúng trở thành nguồn thông dụng nhất hiện nay.



Trên thực tế có khoảng gần 1 triệu người Mỹ chọn trị liệu bằng TBG qua những chương trình du lịch y tế tới các nước Nam Mỹ như Mêhicô, Chilê, hay châu Á như Ấn Độ, Trung Quốc, Singapore, Malaysia, Thái Lan, Philippin. Ở nhiều quốc gia, du lịch y tế dùng TBG đang là một ngành kinh doanh có doanh thu hàng tỷ USD. Và nó càng trở nên hấp dẫn khi ngày càng có nhiều những nhân chứng xác thực về hiệu quả trị liệu như phép màu của TBG đối với những căn bệnh nan y. Một chi tiết đặc biệt cần được lưu ý là, đã có rất nhiều công nghệ y sinh tiên tiến được ứng dụng trong các thập niên vừa qua như kháng thể đơn dòng; trị liệu gene; vacxin trị ung thư; tế bào miễn dịch như tế bào tua, tế bào T, NK… nhưng chưa có công nghệ nào được dùng trị liệu ngoài luồng phổ biến và nhiều nơi như TBG. Công bằng mà nói thì tất cả mọi loại thuốc và trị liệu đều có thể gây phản ứng phụ từ không nguy hiểm cho đến nguy hiểm. Trị liệu TBG tự thân thường được quảng bá là an toàn, do đó có thể tạo niềm tin là dùng trị liệu TBG nếu không khỏi bệnh thì cũng chẳng có phản ứng bất lợi nào đối với bệnh nhân. Đây là quan điểm sai lầm. Như trên đã phân tích, tự bản chất TBG rất phức tạp nên bất cứ một thao tác nào cũng có thể gây phản ứng với cơ thể và mang lại hậu quả khó lường. Tuy nhiên, với những gì đang diễn ra, chúng ta cần thẩm định TBG theo nhận định thực tiễn, và công bằng hơn là theo những phê phán kinh điển, tháp ngà để từ đó xây dựng nên những ứng dụng TBG an toàn, đem lại lợi ích thiết thực cho nhu cầu sức khỏe của đại chúng.
Việt Nam cần làm gì?
TBG là khoa học của thế kỷ và của tương lai. Việt Nam có thể dựa vào công nghệ TBG làm mũi nhọn nâng khoa học trong nước lên cao hơn trên trường quốc tế. Chiều hướng này đang được thực hiện ở một số cơ sở y tế và chương trình nghiên cứu ở trong nước như Bệnh viện Huyết học và Truyền máu TP Hồ Chí Minh, Bệnh viện Vạn Hạnh (TP Hồ Chí Minh), Trung tâm Vinmec (Hà Nội), Phòng thí nghiệm nghiên cứu và ứng dụng TBG (Đại học Quốc gia TP Hồ Chí Minh)… Trong vòng hai năm gần đây, các bệnh viện và trung tâm khoa học lớn ở Việt Nam đều có hoặc đang xây dựng đơn vị TBG cho nghiên cứu và trị liệu. Mặc dù vậy, đánh giá chung cho thấy, số chuyên gia công nghệ TBG của Việt Nam rất thiếu so với nhu cầu, và các hoạt động nghiên cứu còn ở mức độ nhỏ lẻ. Nhìn về tương lai, Việt Nam cần quan tâm tới một số vấn đề sau:
1) TBG là một khoa học đa ngành nên cần một trung tâm đa khoa để có thể khai triển hữu hiệu và toàn diện công nghệ TBG. Trung tâm này cần có các nhóm giải trình tự gene/genome, phân tích protein/proteonomic để xác định chức năng gene; nhóm sinh tin học để hiểu sâu rộng các thông tin về gene và tác động trên tế bào; nhóm miễn dịch học để thiết kế an toàn và đánh giá hiệu năng của TBG; nhóm vật liệu sinh học để tạo sản phẩm ứng dụng cho TBG; nhóm sinh lý động vật cho đánh giá chức năng TBG trên động vật. Nếu điều kiện chưa cho phép, kế hoạch mở rộng liên kết với nhiều trung tâm trong và ngoài nước là rất cần thiết. Nói chung, mục tiêu cuối cùng là chúng ta có khả năng phân loại các dòng TBG qua cấu trúc genome, giải thích chức năng của TBG bằng cơ chế phân tử, vì đó là giải đáp chính xác và quan trọng cần có cho nghiên cứu TBG hiện đại.
2) Cần tổ chức và xây dựng công nghệ TBG thành một bộ phận thiết yếu của ngành y vì các bác sỹ và chuyên gia y tế chính là những người trực tiếp sử dụng TBG trên bệnh nhân và họ cũng chịu trách nhiệm trong công tác tổ chức, giải quyết hậu quả. Theo nghĩa này, chương trình chuyên ngành Translational medicine, với chức năng ứng dụng các kết quả nghiên cứu TBG ở các phòng thí nghiệm cho người bệnh của các trung tâm y tế là thiết yếu. Ở nhiều trường y khoa trên thế giới, ngoài những nghiên cứu cơ bản, đều có ngành Translational medicine để thực hiện mục đích này.
3) Tận dụng ưu thế bệnh lý, môi trường ở Việt Nam để tạo các dòng iPS sử dụng trong nghiên cứu và trị liệu. Thực tế chúng ta có thể tạo ngân hàng iPS cho rất nhiều bệnh lý từ các bệnh nhân và dùng đánh giá nguyên nhân gây bệnh, hiệu năng trị liệu hay tính kháng thuốc để từ đó tìm ra những phương thức trị liệu hữu hiệu và mới mẻ. Chẳng hạn ở Việt Nam đã có rất nhiều bệnh do phơi nhiễm chất độc da cam/dioxin, việc tạo dòng iPS của những bệnh nhân này sẽ giúp thực hiện nhiều nghiên cứu quan trọng, có giá trị kinh tế cao, vì nhiều hãng dược phẩm trên thế giới rất cần các nghiên cứu chuyên sâu để tìm hiểu vai trò của dioxin đối với chức năng và bệnh lý của hệ miễn dịch. Ngoài ra, các vấn đề môi trường ở Việt Nam hiện đang gây một số bệnh có tính kháng thuốc cao, iPS tạo từ những loại bệnh này sẽ có giá trị quan trọng cho nghiên cứu cơ chế và tìm thuốc mới không riêng cho các nhà nghiên cứu trong nước mà còn cho cả những chương trình quốc tế. Nghiên cứu các chủ đề y tế trên người Việt là một trách nhiệm tinh thần và khoa học. Trên thực tế, các chương trình như vậy còn có giá trị chiến lược để tránh các đề tài chung chung mà chúng ta lặp lại và dễ bị đánh giá thấp so với những nước tiên tiến.
4) Cần triển khai TBG chuyển gen trong các nghiên cứu trị liệu mới, tuy nhiên chúng ta sẽ khó đi sâu vào công nghệ này trong sản xuất vì việc tạo dòng, duy trì và sản xuất tốn kém hơn nhiều so với lấy từ bệnh nhân. Thay vào đó, chúng ta đầu tư cải tiến kỹ thuật cho các nguồn TBG đang được ứng dụng như TBG mô mỡ, các nguồn TBG cuống rốn, máu để thu hoạch TBG-TM chất lượng, nâng cấp các phương tiện bảo tồn, quản lý có tiêu chuẩn an toàn cao; ngoài ra các nguồn TBG có hiệu năng trị liệu cao cần được tạo thành dòng tế bào chủ, đánh giá và lưu giữ lâu dài để ứng dụng cho một tập thể rộng lớn.
5) Vì tinh tuý khoa học TBG được phát triển ở các nước tiên tiến, chúng ta cần có một chiến lược hợp tác quốc tế trọng tâm, tạo điều kiện hợp tác qua các hội nghị chuyên ngành, phổ biến thành tựu với cơ quan nước ngoài. Đây là một thử thách không nhỏ vì sự cách biệt về khả năng khoa học và khác biệt về văn hoá. Do đó, việc thu hút các chuyên gia Việt Nam ở nước ngoài có tài và tâm huyết là một kế hoạch cần thiết để rút ngắn khoảng cách hiện đại hoá công nghệ quan trọng này.
6) Về điều hành, cần có sự liên hệ mật thiết hơn giữa các trung tâm nghiên cứu và chính quyền để giảm thiểu rào cản pháp lý cho những ứng dụng khả thi và quan trọng. Vì bản chất xã hội của TBG rất cao, việc thành lập các hiệp hội TBG cấp thành phố, tỉnh sẽ giúp tạo sự tham gia sáng suốt của những bệnh nhân và tránh sự phát triển thiếu tiêu chuẩn ở các địa phương.
7) Điểm cuối cùng và có lẽ quan trọng nhất là cần những kế hoạch mạnh mẽ đầu tư từ Chính phủ và tư nhân. Việc đầu tư một số chương trình trọng điểm, thay vì dàn trải, cho nghiên cứu TBG là rất cần thiết và hợp lý trong hoàn cảnh thiếu chuyên gia và nhân lực như Việt Nam. Ở nước ngoài, các nguồn tài trợ được phân bổ rất hợp lý. Các cơ quan tài trợ chính phủ như NIH (National Institute of Health), NSF (National Science Foundation), CDC (Center for Disease Control), DOD (Department of Defense) được dành cho phát triển nghiên cứu cơ bản. Các hãng dược thường tham gia vào các nghiên cứu tiềm năng ở các đại học. Khi có thành quả thì họ đầu tư kinh phí rất nhiều để đẩy mạnh và đi nhanh đến sản xuất. Các hãng dược cung cấp khoảng 60% kinh phí ở các đại học vì họ biết lợi nhuận thu lại sẽ là gấp bội. Họ có tầm nhìn và chiến lược rất hữu hiệu cho đầu tư công nghệ sinh học. Rất mong trong thời gian tới, các hãng dược trong nước sẽ đầu tư mạnh hơn vào công nghệ TBG. Như vậy, nếu chúng ta phát triển mạnh mẽ nghiên cứu TBG ở các trường đại học, trung tâm nghiên cứu trong nước; áp dụng và xử lý tốt, an toàn ở các bệnh viện; tiếp cận rộng rãi các chương trình nghiên cứu hiện đại trên thế giới, thì chúng ta có thể chuyển đổi trị liệu TBG “không chính thống” thành “chính thống” và tiến tới những thành quả to lớn, quan trọng cho công nghệ TBG trong y tế và khoa học Việt Nam.
Tài liệu tham khảo
(các tài liệu dưới đây có tính gợi ý cho một số khía cạnh của bài viết này)
Về tổ chức, phát triển và an toàn của trị liêu TBG:
- Positioning a Scientific Community on Unproven Cellular Therapies: The 2015 International Society for Cellular Therapy Perspective. Dominici M, Nichols K, Srivastava A, Weiss DJ, Eldridge P, Cuende N, Deans RJ, Rasko JE, Levine AD, Turner L, Griffin DL, O’Donnell L, Forte M, Mason C, Wagena E, Janssen W, Nordon R, Wall D, Ho HN, Ruiz MA, Wilton S, Horwitz EM, Gunter KC; 2013–2015 ISCT Presidential Task Force on Unproven Cellular Therapy. Cytotherapy. 2015 Dec;17(12):1663-6. doi: 10.1016/j.jcyt.2015.10.007.
- Preclinical biosafety evaluation of cell-based therapies: emerging global paradigms. Basu J, Assaf BT, Bertram TA, Rao M. Toxicol Pathol. 2015 Jan;43(1):115-25. doi: 10.1177/0192623314559104. Epub 2014 Dec 4. Review.
- Risk factors in the development of stem cell therapy. Carla A HerbertsEmail author, Marcel SG Kwa and Harm PH Hermsen. Journal of Translational Medicine 20119:29.
- Unproven stem cell-based interventions and achieving a compromise policy among the multiple stakeholders. Matthews KR, Iltis AS. BMC Med Ethics. 2015 Nov 4;16(1):75. doi: 10.1186/s12910-015-0069-x.
- Malignancies After Hematopoietic Stem Cell Transplantation: Many Questions, Some Answers. H. Joachim Deeg and Gérard Socié. March 15, 1998; Blood: 91 (6) US stem cell clinics, patient safety, and the FDA. Turner L. Trends Mol Med. 2015 May; 21(5):271-3. doi: 10.1016/j.molmed.2015.02.008.
- Advances in stem cells technologies and their commercialization potential. Kamarul T. Expert Rev Clin Pharmacol. 2013 Jul;6(4):363-5. doi: 10.1586/17512433.2013.811804.
- The market trend analysis and prospects of scaffolds for stem cells. Lee S, Kwon T, Chung EK, Lee JW. Biomater Res. 2014 Sep 1;18:11. doi: 10.1186/2055-7124-18-11. eCollection 2014.
- Hurdles to clinical translation of human induced pluripotent stem cells. Neofytou E, O’Brien CG, Couture LA, Wu JC. J Clin Invest. 2015 Jul 1;125(7):2551-7. doi: 10.1172/ JCI80575. Epub 2015 Jul 1. Review.
- Challenging Regeneration to Transform Medicine. Tsukamoto A, Abbot SE, Kadyk LC, DeWitt ND, Schaffer DV, Wertheim JA, Whittlesey KJ, Werner MJ.. Stem Cells Transl Med. 2016 Jan;5(1):1-7. doi: 10.5966/sctm.2015-0180. Epub 2015 Nov 25.
- New Japanese Initiatives on Stem Cell Therapies Kenji Konomicorrespondenceemail, Morikuni Tobita, Kenichi Kimura, Daisaku Sato. Cell Stem Cell. Volume 16, Issue 4, p350–352, 2 April 2015.
- A developmental framework for induced pluripotency. Takahashi K, Yamanaka S. Development. 2015 Oct 1;142(19):3274-85. doi: 10.1242/dev.114249. Review.
- From Genomics to Gene Therapy: Induced Pluripotent Stem Cells Meet Genome Editing. Hotta A, Yamanaka S. Annu Rev Genet. 2015 Nov 23;49:47-70. doi: 10.1146/ annurev-genet-112414-054926. Epub 2015 Sep 25.
- CRISPR/Cas9 and cancer targets: future possibilities and present challenges. White MK, Khalili K. Oncotarget. 2016 Jan 31. doi: 10.18632/oncotarget.7104. [Epub ahead of print] Review.
- Direct conversion of adult skin fibroblasts to endothelial cells by defined factors. Han JK, Chang SH, Cho HJ, Choi SB, Ahn HS, Lee J, Jeong H, Youn SW, Lee HJ, Kwon YW, Cho HJ, Oh BH, Oettgen P, Park YB, Kim HS. Circulation. 2014 Sep 30;130(14):1168-78. doi: 10.1161/CIRCULATIONAHA.113.007727. Epub 2014 Sep 3.
- Very small embryonic-like stem cells as a novel developmental concept and the hierarchy of the stem cell compartment Advances in Medical Sciences Volume 59, Issue 2, September 2014, Pages 273–280
- Rare somatic cells from human breast tissue exhibit extensive lineage plasticity Somdutta Roya, Philippe Gascarda, Nancy Dumonta, Jianxin Zhaoa, Deng Pana, Sarah Petriea, Marta Margetab, and Thea D. Tlstya PNAS, vol. 110 no. 12, 4598–4603, doi: 10.1073/pnas.1218682110
- The Use of Induced Pluripotent Stem Cells for the Study and Treatment of Liver Diseases. Hansel MC, Davila JC, Vosough M, Gramignoli R, Skvorak KJ, Dorko K, Marongiu F, Blake W, Strom SC. Curr Protoc Toxicol. 2016 Feb 1;67:14.13.1 14.13.27.
- Adipose-Derived Stem Cells Promote Peripheral Nerve Regeneration In Vivo without Differentiation into Schwann-Like Lineage. Sowa Y, Kishida T, Imura T, Numajiri T, Nishino K, Tabata Y, Mazda O. Plast Reconstr Surg. 2016 Feb;137(2):318e-30e. doi: 10.1097/01.prs.0000475762.86580.36.
- Efficacy of Mesenchymal Stromal Cell Therapy for Acute Lung Injury in Preclinical Animal Models: A Systematic Review. McIntyre LA, Moher D, Fergusson DA, Sullivan KJ, Mei SH, Lalu M, Marshall J, Mcleod M, Griffin G, Grimshaw J, Turgeon A, Avey MT, Rudnicki MA, Jazi M, Fishman J, Stewart DJ; Canadian Critical Care Translational Biology Group. PLoS One. 2016 Jan 28;11(1):e0147170. doi: 10.1371/journal.pone. 0147170. eCollection 2016.
- Adult Mesenchymal Stem Cells: When, Where, and How. Caplan AI. Stem Cells Int. 2015;2015:628767. doi: 10.1155/2015/628767. Epub 2015 Jul 26. Review.
- Regenerating the injured kidney with human umbilical cord mesenchymal stem cellderived exosomes. Dorronsoro A, Robbins PD Stem Cell Res Ther. 2013 Apr 25;4(2): 39. doi: 10.1186/scrt187.
- Platelet-rich plasma enhanced umbilical cord mesenchymal stem cells-based bone tissue regeneration. Wen Y, Gu W, Cui J, Yu M, Zhang Y, Tang C, Yang P, Xu X.Arch Oral Biol. 2014 Nov;59(11):1146-54. doi: 10.1016/j.archoralbio.2014.07.001. Epub 2014 Jul 15.
- Biobanking human embryonic stem cell lines: policy, ethics and efficiency. Holm S. Monash Bioeth Rev. 2016 Jan 13.
- http://stemcellassays.com/2015/01/b...gulation-adipose-tissuederived-cell-products/
- http://alliancerm.org/page/about-us
- http://aact.co/about/
- http://www.bioinformant.com/comparison-of-stem-cell-research-frequency-by-stem-celltype/
- http://www.medi-post.co.kr/neurostem/
- http://time.com/4091290/right-to-try/
- http://stemcells.nih.gov/policy/pages/2009guidelines.aspx
- http://blog.cirm.ca.gov/
- http://www.sciencemag.org/news/2014...ell-institute-picks-industryveteran-president
- http://vinastemcelllab.com/vi/
- http://vinmec.com/tin-tuc-hoat-dong...h-cong-ghep-te-bao-gocchua-bai-nao-a1298.html
- http://benhvienvanhanh.com/tebaogoc/
- http://tiasang.com.vn/Default.aspx?tabid=111&CategoryID=2&News=8452
- http://infonet.vn/pgs-phan-toan-thang-mang-day-ron-la-bao-hiem-sinh-hoc-cho-connguoi-post153375.info
- http://www.mekostem.com/vn/Dich-vu/Dich-vu-luu-giu-te-bao-goc-mang-day-ron-theoyeu-cau.html
Tác giả bài viết: TS. Nguyễn Đức Thái – Cố vấn Khoa học, PTN Tế Bào Gốc, ĐHQG & Chương trình Sinh Học Lâm Sàng (Translational Medicine), ĐH Y Dược – Tp HCM
Biên tập và chỉnh sửa: Biomedia Việt Nam
(Tham khảo từ Tạp chí Khoa học Công nghệ VN)
Biên tập và chỉnh sửa: Biomedia Việt Nam
(Tham khảo từ Tạp chí Khoa học Công nghệ VN)
More...

