Navigation
Install the app
How to install the app on iOS
Follow along with the video below to see how to install our site as a web app on your home screen.
Note: This feature may not be available in some browsers.
More options
You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
phương pháp PCR
- Thread starter bonbonsin
- Start date
Phương pháp PCR
Giới thiệu chung
Phương pháp PCR (Polymerase Chain Reaction) được Kary Mullis và cộng sự (Mỹ) phát minh năm 1985 và kể từ đó đã tạo nên một tác động to lớn đối với các nghiên cứu sinh học trên toàn thế giới.
Nguyên tắc
Ðây là phương pháp in vitro sử dụng các cặp mồi để tổng hợp số lượng lớn các bản sao từ một trình tự ADN đặc biệt dựa trên hoạt động của enzyme polymerase. Phương pháp PCR dựa trên hoạt động của ADN polymerase trong quá trình tổng hợp ADN mới từ mạch khuôn. Tất cả các ADN polymerase đều cần những mồi, là những đoạn ADN ngắn có khả năng bắt cặp bổ sung với một đầu của mạch khuôn. Ðoạn mồi này sau đó sẽ được nối dài ra nhờ hoạt động của ADN polymerase để hình thành một mạch mới hoàn chỉnh.
Một phản ứng PCR là một chuỗi nhiều chu kỳ nối tiếp nhau, mỗi chu kỳ gồm ba
giai đoạn:
- Giai đoạn biến tính: tách chuỗi ADN từ mạch đôi thành dạng mạch đơn
- Giai đoạn bắt cặp: gắn cặp mồi đặc trưng theo nguyên tắc bổ sung
- Giai đoạn kéo dài chuỗi: tổng hợp chuỗi AND mới giống chuỗi AND gốc .
Các thành phần tham gia thử nghiệm PCR
Ðể thử nghiệm PCR có thể chạy được, cần phải có đầy đủ các thành phần sau đây :
* DNA hay nuceic acid đích, tức là chuỗi acid nucleic (ví dụ đoạn acid nucleic đặc hiệu của vi khuẩn gây bệnh, của gene bệnh lý, của dấu ấn di truyền,. ) mà phản ứng PCR sẽ khuếch đại lên để chúng có thể được phát hiện trong bệnh phẩm. Phản ứng PCR sẽ không xảy ra được nếu bệnh phẩm không có nucleic acid đích. Một trường hợp khác là trong bệnh phẩm có nucleic acid đích, nhưng do bệnh phẩm được sửa soạn không thích hợp hoặc không đúng cách nên nucleic acid đích không bộc lộ ra ; hoặc trong bệnh phẩm hãy còn các chất ức chế phản ứng PCR. Trong những trường hợp này kết quả PCR sẽ âm tính, nhưng là âm tính giả. Vì vậy vấn đề sửa soạn bệnh phẩm cho thử nghiệm PCR phải được coi trọng, đặc biệt trong các phòng thí nghiệm áp dụng PCR để chẩn đoán phát hiện bệnh.
* Primer hay đoạn mồi, tức là những đoạn DNA đơn (oligonucleotide) có kích thước chỉ vài chục base (18-30), có thể bắt cặp theo nguyên tắc bổ sung vào đoạn khởi đầu và đoạn kết thúc của chuỗi DNA đích khi chuỗi đích này được biến tính thành sợi đan. Trong thử nghiệm PCR, đoạn mồi có hai vai trò chính : (1) Quyết định nên tính đặc hiệu của thử nghiệm, vì nếu đoạn mồi được chọn càng đặc hiệu cho chuỗi đích, nghĩa là chỉ có thể bắt cặp trên chuỗi đích mà không thể bắt cặp được trên các chuỗi DNA khác ngoài chuỗi đích, thì sản phẩm PCR càng đặc hiệu và thử nghiệm PCR càng đặc hiệu. (11) Khởi động men polymerase vì men polymerase chỉ có thể bắt đầu tổng hợp sợi bổ sung cho chuỗi DNA đích một khi nó nhận dạng được đầu 3', (là đầu mà nó xúc tác cho một dNTP được gắn vào) đang ở tình trạng sợi đôi. Thông thường trong phản ứng PCR, người ta dùng một cặp mồi, gọi là primer set, trong đó có một mồi lên gọi là up-stream primer và một mồi xuống gọi là down-stream prime. Cặp mồi này quyết định nên kích thước củasản phẩm PCR. Chúng càng bắt cặp trên chuỗi đích xa nhau bao nhiêu thì kích thước của sản phẩm PCR càng lớn bấy nhiêu và ngược lại, càng gần nhau bao nhiêu thì kích thước càng nhỏ bấy nhiêu.
* dNTP, deoxy nucleoside triphosphate, tức là đơn vị để có thể tổng hợp được các bản sao của DNA đích. DNTP có cấu tạo gồm một đường deoxyribose có gắn một base, có thể là adenine (dATP) hay thymine (dTTP) hay Cytosine (dCTP) hay guanine (dGTP) , ở carbone số 1 (C1). Ba phân tử phosphate (triphosphate) được gắn tại carbone số 5 (C5) của phân tử deoxyribose này và đây chính là nơi mà dNTP gắn vào đầu 3' của chuỗi bổ sung trên chuỗi đích. Năng lương để cho phản ứng này xảy ra được lấy từ các nối phosphate giàu năng lương của triphosphate trên dNTP. Ðó cũng chính là lý do tại sao phải là dNTP chứng không phải là dNDP (diphosphate) hay dNMP(monophosphate).
* Men polymerase, phải là men polymerase chịu được nhiệt độ. Ngày nay có nhiều loại polymerase chịu được nhiệt độ đã được ly trích hoặc tổng hợp, tùy mục đích sử dụng mà chúng ta có thể chọn polymerase thích hợp. Thường dùng nhất trong các phòng thí nghiệm là men Taq polymerase. Là men polymerase trích từ vi khuẩn Thermus aquaticus, là các vi khuẩn sống được trong các suối nước nóng.
* Dung dịch đệm cho phản ứng PCR, thường chứa muối đệm Tris HCL 10 mM, KCL 50Mm và MgCl2 2 1.5mM. Ngoài ra dung dịch đệm PCR còn có thể chứa 0.001% BSA hay Gelatine và trong một số phản ứng PCR còn có thể thêm tween hay formamide nữa. Trong các thành phần trên, có lẽ ảnh hưởng lên thử nghiệm PCR nhiều nhất là nồng độ MgCl2, vì vậy để có được một thử nghiệm PCR có độ nhạy cao, phả ứng rõ nét, người ta phải tối ưu hóa phản ứng bằng cách thăm dò một nồng độ MgCl2 thích hợp nhất.
Hai bước tiến quan trọng đã đưa thử nghiệm PCR đến cuộc đại cách mạng sinh học phân tử
Sự phát hiện ra các men polymerase chịu nhiệt độ
Chính việc phát hiện được các men polymerase chịu nhiệt là bước tiến đầu tiên đã làm thử nghiệm PCR trở nên đơn giản hơn. Thử tưởng tượng nếu không men polymerase chịu nhiệt thì thử nghiệm PCR sẽ phức tạp và kém hiệu quả bao nhiêu một khi mà cứ sau mỗi chu kỳ nhiệt lại phải thêm men polymerase mới vào vì men cũ đã bị hủy bởi nhiệt độ trong chu kỳ nhiệt trước đó ? Cũng nhờ sự sử dụng các men polymerase chịu nhiệt mà giai đoạn bắt cặp của đoạn mồi vào nucleic acid đích được đặc hiệu hơn vì được thực hiện ở nhiệt độ cao hơn, do đó phản ứng PCR trở nên đặc hiệu hơn. Cho đến nay, đã có hàng chục loại polymerase chịu nhiệt đã được phát hiện và tổng hợp ra [1]. Có những men polymerase trích từ các vi khuẩn chịu nhiệt như Thermus aquaticus (Taq polymerase), Thermus thermophilus (rTth), Thermus lithoralis (Vent), Pyrococcus furiosus (Pfu),. Có những men polymerase chịu nhiệt được tổng hợp từ các ci khuẩn không chịu nhiệt nhưng mang gen tái tổ hợp từ các vi khuẩn chịu nhiệt như Ampli Taq, Vent (exo),. Có những men polymerase chịu nhiệt có hoạt tính sửa sai (proofreading) khi tổng hợp chuỗi nucleic acid bổ sung (3-5exonuclease) như Ultima, Vent, Deep Vent, Pfu,. Nhờ vậy mà người dùng có rất nhiều chọn lựa để sử dụng cho đúng mục đích của mình.
Máy chu kỳ nhiệt
Trước đây, khi chưa có máy chu kỳ nhiệt, thử nghiệm PCR được thực hiện bằng cách liên túc chuyển các ống nghiệm phản ứng PCR vào các máy các thủy có nhiệt độ khác nhau để tạo ra được các chu kỳ nhiệt cho phản ứng. Dau đó công việc bằng tay nhàm chán và nặng nhọc này được thay thế bằng các robot tương đối cồng kềnh và đắt tiền. Ngày nay, thử nghiệm PCR được thực hiện trong các buồng ủ PCR của máy chu kỳ nhiệt, còn gọi là máy luân nhiệt. Một cách tổng quát, máy luân nhiệt gồm các bộ phận chính như sau :
� Một bàn phím đơn giản để lập các chương trình chu kỳ nhiệt và ra các mệnh lệnh để máy thực hiện.
� Một bộ vi xử lý để ghi nhớ các chương trình đã nạp vào máy, thực hiện các mệnh lệnh đền buồng ủ PCR, cũng như ghi nhận cách thay đổi nhiệt độ buồng ủ PCR trong các chu kỳ nhiệt để điều chỉnh cho đúng với chương trình đang được thực hiện.
� Buồng ủ PCR là nơi mà các chu kỳ nhiệt được thực hiện qua dự điều khiển của bộ vi xử lý. Trong các chu kỳ nhiệt, nhiệt độ trong buồng ủ PCR có thể đưa lên cao hay hạ xuống thấp trong một thời gian rất ngắn. Ðể làm thay đổi được nhiệt độ trong buồng ủ PCR, có hai phương pháp : (1) Liên tục thổi lên buồng ủ những luồng khí nóng sinh ra từ một đèn phát nhiệt, hay luồng khí lạnh sinh ra từ một dàn lạnh của máy làm lạch. Với phương pháp này, máy luân nhiệt hãy còn tương đối cồng kềnh, khá đắt tiền và khi máy hoạt động âm thanh cũng khá ồn ào. (11) Phương pháp thứ hai hoạt động dựa theo hiệu quả Peltier ngược. Hiệu quả Peltier là nguyên tắc của các máy đo nhiệt độ điện tử : Khi áp hai mãnh kim loại vào nhau và khi có sự cách biệt nhiệt độ giữa hai mãnh kim loại thì sẽ sinh ra một dòng điện và chính sự lưu thông của dòng điện này khi đo lường ra sẽ phản ánh sự cách biệt nhiệt độ giữa hai mãnh kim loại. Hiệu quả Peltier ngược lại vận hành theo kiểu ngược lại, nghĩa là khi tạo ra một dòng điện giữa hai mãnh kim loại thì sẽ tạo ra được một sự cách biệt nhiệt độ giữa hai mãnh : bên này nóng, bên kia lạnh. Khi thay đổi chiều dòng điện thì nhiệt độ của hai mãnh cũng thay đổi ngược lại : bên này lạnh, bên kia nóng. Các máy chu kỳ nhiệt hiện nay đều được chế tạo dựa theo phương pháp thứ hai này, nhờ vậy mà máy trở nên rất gọn nhẹ, giá thành rẽ hơn gấp nhiều lần so với trứơc đây. Ví dụ hiện nay chúng ta có thể trang bị cho phòng thí nghiệm máy chu kỳ nhiệt nhỏ có 16 giếng phản ứng, với giá chỉ khoảng 1800 USD (minicycler của hãng MJ research) so với hàng chục ngàn USD như trước đây.
[ Theo CLB KT]Phương pháp PCR (Polymerase Chain Reaction) được Kary Mullis và cộng sự (Mỹ) phát minh năm 1985 và kể từ đó đã tạo nên một tác động to lớn đối với các nghiên cứu sinh học trên toàn thế giới.
Nguyên tắc
Ðây là phương pháp in vitro sử dụng các cặp mồi để tổng hợp số lượng lớn các bản sao từ một trình tự ADN đặc biệt dựa trên hoạt động của enzyme polymerase. Phương pháp PCR dựa trên hoạt động của ADN polymerase trong quá trình tổng hợp ADN mới từ mạch khuôn. Tất cả các ADN polymerase đều cần những mồi, là những đoạn ADN ngắn có khả năng bắt cặp bổ sung với một đầu của mạch khuôn. Ðoạn mồi này sau đó sẽ được nối dài ra nhờ hoạt động của ADN polymerase để hình thành một mạch mới hoàn chỉnh.
Một phản ứng PCR là một chuỗi nhiều chu kỳ nối tiếp nhau, mỗi chu kỳ gồm ba
giai đoạn:
- Giai đoạn biến tính: tách chuỗi ADN từ mạch đôi thành dạng mạch đơn
- Giai đoạn bắt cặp: gắn cặp mồi đặc trưng theo nguyên tắc bổ sung
- Giai đoạn kéo dài chuỗi: tổng hợp chuỗi AND mới giống chuỗi AND gốc .
Các thành phần tham gia thử nghiệm PCR
Ðể thử nghiệm PCR có thể chạy được, cần phải có đầy đủ các thành phần sau đây :
* DNA hay nuceic acid đích, tức là chuỗi acid nucleic (ví dụ đoạn acid nucleic đặc hiệu của vi khuẩn gây bệnh, của gene bệnh lý, của dấu ấn di truyền,. ) mà phản ứng PCR sẽ khuếch đại lên để chúng có thể được phát hiện trong bệnh phẩm. Phản ứng PCR sẽ không xảy ra được nếu bệnh phẩm không có nucleic acid đích. Một trường hợp khác là trong bệnh phẩm có nucleic acid đích, nhưng do bệnh phẩm được sửa soạn không thích hợp hoặc không đúng cách nên nucleic acid đích không bộc lộ ra ; hoặc trong bệnh phẩm hãy còn các chất ức chế phản ứng PCR. Trong những trường hợp này kết quả PCR sẽ âm tính, nhưng là âm tính giả. Vì vậy vấn đề sửa soạn bệnh phẩm cho thử nghiệm PCR phải được coi trọng, đặc biệt trong các phòng thí nghiệm áp dụng PCR để chẩn đoán phát hiện bệnh.
* Primer hay đoạn mồi, tức là những đoạn DNA đơn (oligonucleotide) có kích thước chỉ vài chục base (18-30), có thể bắt cặp theo nguyên tắc bổ sung vào đoạn khởi đầu và đoạn kết thúc của chuỗi DNA đích khi chuỗi đích này được biến tính thành sợi đan. Trong thử nghiệm PCR, đoạn mồi có hai vai trò chính : (1) Quyết định nên tính đặc hiệu của thử nghiệm, vì nếu đoạn mồi được chọn càng đặc hiệu cho chuỗi đích, nghĩa là chỉ có thể bắt cặp trên chuỗi đích mà không thể bắt cặp được trên các chuỗi DNA khác ngoài chuỗi đích, thì sản phẩm PCR càng đặc hiệu và thử nghiệm PCR càng đặc hiệu. (11) Khởi động men polymerase vì men polymerase chỉ có thể bắt đầu tổng hợp sợi bổ sung cho chuỗi DNA đích một khi nó nhận dạng được đầu 3', (là đầu mà nó xúc tác cho một dNTP được gắn vào) đang ở tình trạng sợi đôi. Thông thường trong phản ứng PCR, người ta dùng một cặp mồi, gọi là primer set, trong đó có một mồi lên gọi là up-stream primer và một mồi xuống gọi là down-stream prime. Cặp mồi này quyết định nên kích thước củasản phẩm PCR. Chúng càng bắt cặp trên chuỗi đích xa nhau bao nhiêu thì kích thước của sản phẩm PCR càng lớn bấy nhiêu và ngược lại, càng gần nhau bao nhiêu thì kích thước càng nhỏ bấy nhiêu.
* dNTP, deoxy nucleoside triphosphate, tức là đơn vị để có thể tổng hợp được các bản sao của DNA đích. DNTP có cấu tạo gồm một đường deoxyribose có gắn một base, có thể là adenine (dATP) hay thymine (dTTP) hay Cytosine (dCTP) hay guanine (dGTP) , ở carbone số 1 (C1). Ba phân tử phosphate (triphosphate) được gắn tại carbone số 5 (C5) của phân tử deoxyribose này và đây chính là nơi mà dNTP gắn vào đầu 3' của chuỗi bổ sung trên chuỗi đích. Năng lương để cho phản ứng này xảy ra được lấy từ các nối phosphate giàu năng lương của triphosphate trên dNTP. Ðó cũng chính là lý do tại sao phải là dNTP chứng không phải là dNDP (diphosphate) hay dNMP(monophosphate).
* Men polymerase, phải là men polymerase chịu được nhiệt độ. Ngày nay có nhiều loại polymerase chịu được nhiệt độ đã được ly trích hoặc tổng hợp, tùy mục đích sử dụng mà chúng ta có thể chọn polymerase thích hợp. Thường dùng nhất trong các phòng thí nghiệm là men Taq polymerase. Là men polymerase trích từ vi khuẩn Thermus aquaticus, là các vi khuẩn sống được trong các suối nước nóng.
* Dung dịch đệm cho phản ứng PCR, thường chứa muối đệm Tris HCL 10 mM, KCL 50Mm và MgCl2 2 1.5mM. Ngoài ra dung dịch đệm PCR còn có thể chứa 0.001% BSA hay Gelatine và trong một số phản ứng PCR còn có thể thêm tween hay formamide nữa. Trong các thành phần trên, có lẽ ảnh hưởng lên thử nghiệm PCR nhiều nhất là nồng độ MgCl2, vì vậy để có được một thử nghiệm PCR có độ nhạy cao, phả ứng rõ nét, người ta phải tối ưu hóa phản ứng bằng cách thăm dò một nồng độ MgCl2 thích hợp nhất.
Hai bước tiến quan trọng đã đưa thử nghiệm PCR đến cuộc đại cách mạng sinh học phân tử
Sự phát hiện ra các men polymerase chịu nhiệt độ
Chính việc phát hiện được các men polymerase chịu nhiệt là bước tiến đầu tiên đã làm thử nghiệm PCR trở nên đơn giản hơn. Thử tưởng tượng nếu không men polymerase chịu nhiệt thì thử nghiệm PCR sẽ phức tạp và kém hiệu quả bao nhiêu một khi mà cứ sau mỗi chu kỳ nhiệt lại phải thêm men polymerase mới vào vì men cũ đã bị hủy bởi nhiệt độ trong chu kỳ nhiệt trước đó ? Cũng nhờ sự sử dụng các men polymerase chịu nhiệt mà giai đoạn bắt cặp của đoạn mồi vào nucleic acid đích được đặc hiệu hơn vì được thực hiện ở nhiệt độ cao hơn, do đó phản ứng PCR trở nên đặc hiệu hơn. Cho đến nay, đã có hàng chục loại polymerase chịu nhiệt đã được phát hiện và tổng hợp ra [1]. Có những men polymerase trích từ các vi khuẩn chịu nhiệt như Thermus aquaticus (Taq polymerase), Thermus thermophilus (rTth), Thermus lithoralis (Vent), Pyrococcus furiosus (Pfu),. Có những men polymerase chịu nhiệt được tổng hợp từ các ci khuẩn không chịu nhiệt nhưng mang gen tái tổ hợp từ các vi khuẩn chịu nhiệt như Ampli Taq, Vent (exo),. Có những men polymerase chịu nhiệt có hoạt tính sửa sai (proofreading) khi tổng hợp chuỗi nucleic acid bổ sung (3-5exonuclease) như Ultima, Vent, Deep Vent, Pfu,. Nhờ vậy mà người dùng có rất nhiều chọn lựa để sử dụng cho đúng mục đích của mình.
[URL="http://i479.photobucket.com/albums/rr159/freeman456/300px-Thermus_aquaticus.jpg"]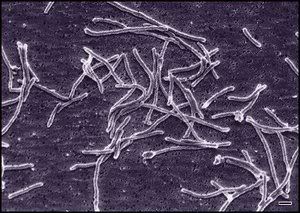 [/URL]
[/URL]
Thermus aquaticus
[URL="http://i479.photobucket.com/albums/rr159/freeman456/052a1.jpg"] [/URL]
[/URL]
Thermus thermophilus
 [/URL]
[/URL]Thermus aquaticus
[URL="http://i479.photobucket.com/albums/rr159/freeman456/052a1.jpg"]
 [/URL]
[/URL]Thermus thermophilus
Máy chu kỳ nhiệt
Trước đây, khi chưa có máy chu kỳ nhiệt, thử nghiệm PCR được thực hiện bằng cách liên túc chuyển các ống nghiệm phản ứng PCR vào các máy các thủy có nhiệt độ khác nhau để tạo ra được các chu kỳ nhiệt cho phản ứng. Dau đó công việc bằng tay nhàm chán và nặng nhọc này được thay thế bằng các robot tương đối cồng kềnh và đắt tiền. Ngày nay, thử nghiệm PCR được thực hiện trong các buồng ủ PCR của máy chu kỳ nhiệt, còn gọi là máy luân nhiệt. Một cách tổng quát, máy luân nhiệt gồm các bộ phận chính như sau :
� Một bàn phím đơn giản để lập các chương trình chu kỳ nhiệt và ra các mệnh lệnh để máy thực hiện.
� Một bộ vi xử lý để ghi nhớ các chương trình đã nạp vào máy, thực hiện các mệnh lệnh đền buồng ủ PCR, cũng như ghi nhận cách thay đổi nhiệt độ buồng ủ PCR trong các chu kỳ nhiệt để điều chỉnh cho đúng với chương trình đang được thực hiện.
� Buồng ủ PCR là nơi mà các chu kỳ nhiệt được thực hiện qua dự điều khiển của bộ vi xử lý. Trong các chu kỳ nhiệt, nhiệt độ trong buồng ủ PCR có thể đưa lên cao hay hạ xuống thấp trong một thời gian rất ngắn. Ðể làm thay đổi được nhiệt độ trong buồng ủ PCR, có hai phương pháp : (1) Liên tục thổi lên buồng ủ những luồng khí nóng sinh ra từ một đèn phát nhiệt, hay luồng khí lạnh sinh ra từ một dàn lạnh của máy làm lạch. Với phương pháp này, máy luân nhiệt hãy còn tương đối cồng kềnh, khá đắt tiền và khi máy hoạt động âm thanh cũng khá ồn ào. (11) Phương pháp thứ hai hoạt động dựa theo hiệu quả Peltier ngược. Hiệu quả Peltier là nguyên tắc của các máy đo nhiệt độ điện tử : Khi áp hai mãnh kim loại vào nhau và khi có sự cách biệt nhiệt độ giữa hai mãnh kim loại thì sẽ sinh ra một dòng điện và chính sự lưu thông của dòng điện này khi đo lường ra sẽ phản ánh sự cách biệt nhiệt độ giữa hai mãnh kim loại. Hiệu quả Peltier ngược lại vận hành theo kiểu ngược lại, nghĩa là khi tạo ra một dòng điện giữa hai mãnh kim loại thì sẽ tạo ra được một sự cách biệt nhiệt độ giữa hai mãnh : bên này nóng, bên kia lạnh. Khi thay đổi chiều dòng điện thì nhiệt độ của hai mãnh cũng thay đổi ngược lại : bên này lạnh, bên kia nóng. Các máy chu kỳ nhiệt hiện nay đều được chế tạo dựa theo phương pháp thứ hai này, nhờ vậy mà máy trở nên rất gọn nhẹ, giá thành rẽ hơn gấp nhiều lần so với trứơc đây. Ví dụ hiện nay chúng ta có thể trang bị cho phòng thí nghiệm máy chu kỳ nhiệt nhỏ có 16 giếng phản ứng, với giá chỉ khoảng 1800 USD (minicycler của hãng MJ research) so với hàng chục ngàn USD như trước đây.
ứng dụng phương pháp pcr để tìm vi trùng lao
(Polymerase Chain Reaction)
Ts Lâm-Kim-Cương, đại học Rutgers New Jersey
Mycobacterium tuberculosis không thuộc nhóm Gram + hay Gram – vì phương pháp nhuộm Gram không nhuộm được nó mặc dầu vi trùng này cũng có 1 màng bọc peptydoglycan. Ngoài màng này còn có 1 màng sáp làm cho các thuốc nhuộm Gram không thấm vào được. Phương pháp thường dùng để tìm M. tuberculosis là phết đàm bệnh nhân lên kiếng (slide smear) và nhuộm bằng Ziehl-Neelsen Stain (Acid-fast Staining Method). Thuốc nhuộm carbon-fuchsin được đổ lên smear có vi trùng rối nung sôi để chất màu có thể thấm vào vi trùng, sau đó rửa bằng cồn acid (acid-alcohol). Vi trùng lao sẽ hiện ra với màu hồng rất dễ phân biệt với các vi trùng khác.
Vi trùng M. tuberculosis rất khó nuôi và sinh trưởng rất chậm. Vì vậy muốn làm thử nghiệm để xem vi trùng nhạy cảm hay kháng thuốc thì cần phải có một thời gian tối thiểu 3-4 tháng mới có kết quả. Dùng phương pháp nuôi vi trùng bằng chất lỏng (liquid media) như BACTEC Systems (Becton Dickinson, Sparks, MD,USA) thì cũng phải 3-4 tuần và cần nhiều dụng cụ đặc biệt đắt giá.
Hiện nay có rất nhiều nghiên cứu dùng PCR để định vi trùng lao (identify) và xét định xem vi trùng sẽ kháng loại thuốc nào. Phản ứng PCR sẽ cho kết quả nhanh chóng trong khoảng 3-4 tiếng đồng hồ.
Bộ gen (genome) của Mycobacterium tuberculosis gồm 44,411,529 base pairs với 4000 gen trong đó có gen IS6110 được rải rác nhiều nơi trong bộ gen. IS6110 có sequence rất cố định (very conservative). Phương pháp PCR để tìm vi trùng Mycobacterium tuberculosis dựa trên amplification của gen IS6110 .DNA của Mycobacterium tuberculosis được trích tinh (purification) và dùng cho PCR với 2 dây mồi (primers). PCR sẽ amplify một đoạn DNA (fragment) khoảng 120bp chuyên biệt cho gen IS6110. Khi PCR hoàn tất, chất thử nghiệm (sample) sẽ dùng để điện di trên Agarose gel (agarose gel electrophoresis) để xác định kết quả. Sự hiện diện của đoạn DNA chứng minh là có DNA của M. tuberculosis. Nếu không thì kết quả là âm (negative).
Để tìm xem M. tuberculosis sẽ đề kháng loại thuốc nào thì chúng ta sẽ dựa vào sequence của các gen ảnh hưởng cho loại thuốc đó để làm PCR.
1/ Đề kháng thuốc INH (isoniazid)
Quan sát cho thấy là gen làm nhạy cảm thuốc loại INH là katG Codon 315 (katG315). Nếu có sự biến dạng hay đột biến (mutation) ở base thứ 2 của katG (AGC biến thành ACC hay ACA) thì vi trùng sẽ trở thành kháng thuốc INH. Dùng DNA của M. tuberculosis và 2 giây mồi (primers) có sequence: 5’AGCTCGTATGGCACCGGAACC3’ (20mer primer) và 5’AACGGGTCCGGGATGGTG3’ (18mer primer)(1) để làm phản ứng PCR sẽ cho ra 1 đoạn DNA dài 200bp. Khi cắt đoạn này với restriction enzyme HapII sẽ cho ra 1 đoạn DNA dài 153bp (chứng tỏ là vi trùng nhạy cảm với INH). Nếu vi trùng trở nên đề kháng thì mutation AGCà ACC sẽ làm cho đoạn DNA có thệm 1 gốc hapII mới (new HapII restriction site), như vậy enzyme hapII sẽ cắt đoạn DNA thành 2 khúc nhỏ 132bp và 21bp. Khi điện giải trện agarose gel ta sẽ thấy hiện ra 2 đoạn DNA. Như vậy là vi trùng đã kháng thuốc INH.
2/ Đề kháng thuốc rifampin:
Gen cho nhạy cảm rifampin là rpoB. Khác với kháng INH, sự biến dạng (mutation) được thấy ở 3 nơi khác nhau trong gen rpoG (ở codon 516, 526 và 531) khi có đề kháng thuốc Rifampin. Vì vậy trong phản ứng PCR ta cần phải dùng ít nhất là 5 giây mồi (5 primers) mới xác định được các biến dạng của gen rpoG.
Trở ngại khi dùng PCR
Mặc dầu phản ứng PCR rất nhanh (3-4 giờ) nhưng phản ứng này cần dùng DNA tinh khiết trích từ vi trùng Mycobacterium tuberculosis.
Muốn trích tinh chất DNA ta phải nuôi vi trùng M. tuberculosis cho thật nhiều mới đủ số lượng để trích tinh, như vậy cũng phải cần 1 thời gian khá lâu trước khi thực hiện PCR.
Sau khi làm phản ứng PCR phải dùng điện di trên Agarose để xem kết quả (3-4 tiếng đồng hồ).
Trước đây tôi đã có lần trình bày trên DDDK đề tài “Tạo DNA mà không cần phải nuôi vi trùng”.
Ở các phòng thí nghiệm, việc nuôi vi trùng như E. coli rất là thông thường và dễ dàng. Chỉ cần cấy vi trùng trong 1 đêm là có thể có rất nhiều gram vi trùng để ly trích DNA. Trường hợp đặc biệt ở đây là khi gặp phải vi trùng khó nuôi (cần phải nuôi ở nhiệt độ thật cao, nhiệt độ thật thấp, không cần dưỡng khi anaerobic...) hoặc vi trùng sinh trưởng rất chậm như M. tuberculosis phải cần đến 3-4 tháng, hoặc khi ta chỉ có 1 số lượng DNA rất ít (như nước miếng, tóc, 1 giọt máu, 1 tinh trùng...) thì làm sao có thể có số lượng DNA cần thiết để làm PCR.
Một diếu tố (enzyme) mà tôi đã đưa ra công thức để trích tinh và có hoạt tính rất mạnh được gọi là Phi29. Diếu tố này có khả năng amplify thật nhiều DNA trong khoảng thời gian ngắn (3-4 giờ) và ở nhiệt độ 30o C (gọi là Rolling Circle Amplification). Với 1 đơn vị vi trùng (1 bacteria colony), Phi29 có thể amplify DNA của vi trùng lên đến vài ug DNA để có thể làm sequencing hoặc PCR. Nếu dùng 1 ug DNA thì trong khoảng 4 tiếng đồng hồ chúng ta có thể có đến 5 mg DNA tinh khiết để dùng cho các thử nghiệm mà khỏi phải mất thời giờ nuôi cấy vi trùng và ly trích DNA.
Hiện nay qPCR (quick PCR) còn gọi là RT-PCR (Real Time PCR) được thông dụng hơn PCR vì RT-PCR dùng rất ít DNA mẫu (DNA template) khoảng 1-10 pg cho phản ứng. Kết quả của phản ứng sẽ hiện lên trên màn ảnh (monitor) của máy vi tính và những chi tiết dữ kiện (data) sẽ được giữ lại ở ổ cứng (hard drive) của máy. Như vậy khi dùng RT-PCR chúng ta sẽ có kết quả sau 3-4 giờ phản ứng mà khỏi phải dùng Agarose gel.
Ts Lâm-Kim-Cương
Ghi chú: (1) 20mers primer là giây mồi có 20 base và 18mers primer là giây mồi 18 base. Hai giây mồi này dùng làm PCR trên gen katG.
[ theo Y dược ngày nay]
(Polymerase Chain Reaction)
Ts Lâm-Kim-Cương, đại học Rutgers New Jersey
Mycobacterium tuberculosis không thuộc nhóm Gram + hay Gram – vì phương pháp nhuộm Gram không nhuộm được nó mặc dầu vi trùng này cũng có 1 màng bọc peptydoglycan. Ngoài màng này còn có 1 màng sáp làm cho các thuốc nhuộm Gram không thấm vào được. Phương pháp thường dùng để tìm M. tuberculosis là phết đàm bệnh nhân lên kiếng (slide smear) và nhuộm bằng Ziehl-Neelsen Stain (Acid-fast Staining Method). Thuốc nhuộm carbon-fuchsin được đổ lên smear có vi trùng rối nung sôi để chất màu có thể thấm vào vi trùng, sau đó rửa bằng cồn acid (acid-alcohol). Vi trùng lao sẽ hiện ra với màu hồng rất dễ phân biệt với các vi trùng khác.
Vi trùng M. tuberculosis rất khó nuôi và sinh trưởng rất chậm. Vì vậy muốn làm thử nghiệm để xem vi trùng nhạy cảm hay kháng thuốc thì cần phải có một thời gian tối thiểu 3-4 tháng mới có kết quả. Dùng phương pháp nuôi vi trùng bằng chất lỏng (liquid media) như BACTEC Systems (Becton Dickinson, Sparks, MD,USA) thì cũng phải 3-4 tuần và cần nhiều dụng cụ đặc biệt đắt giá.
Hiện nay có rất nhiều nghiên cứu dùng PCR để định vi trùng lao (identify) và xét định xem vi trùng sẽ kháng loại thuốc nào. Phản ứng PCR sẽ cho kết quả nhanh chóng trong khoảng 3-4 tiếng đồng hồ.
Bộ gen (genome) của Mycobacterium tuberculosis gồm 44,411,529 base pairs với 4000 gen trong đó có gen IS6110 được rải rác nhiều nơi trong bộ gen. IS6110 có sequence rất cố định (very conservative). Phương pháp PCR để tìm vi trùng Mycobacterium tuberculosis dựa trên amplification của gen IS6110 .DNA của Mycobacterium tuberculosis được trích tinh (purification) và dùng cho PCR với 2 dây mồi (primers). PCR sẽ amplify một đoạn DNA (fragment) khoảng 120bp chuyên biệt cho gen IS6110. Khi PCR hoàn tất, chất thử nghiệm (sample) sẽ dùng để điện di trên Agarose gel (agarose gel electrophoresis) để xác định kết quả. Sự hiện diện của đoạn DNA chứng minh là có DNA của M. tuberculosis. Nếu không thì kết quả là âm (negative).
Để tìm xem M. tuberculosis sẽ đề kháng loại thuốc nào thì chúng ta sẽ dựa vào sequence của các gen ảnh hưởng cho loại thuốc đó để làm PCR.
1/ Đề kháng thuốc INH (isoniazid)
Quan sát cho thấy là gen làm nhạy cảm thuốc loại INH là katG Codon 315 (katG315). Nếu có sự biến dạng hay đột biến (mutation) ở base thứ 2 của katG (AGC biến thành ACC hay ACA) thì vi trùng sẽ trở thành kháng thuốc INH. Dùng DNA của M. tuberculosis và 2 giây mồi (primers) có sequence: 5’AGCTCGTATGGCACCGGAACC3’ (20mer primer) và 5’AACGGGTCCGGGATGGTG3’ (18mer primer)(1) để làm phản ứng PCR sẽ cho ra 1 đoạn DNA dài 200bp. Khi cắt đoạn này với restriction enzyme HapII sẽ cho ra 1 đoạn DNA dài 153bp (chứng tỏ là vi trùng nhạy cảm với INH). Nếu vi trùng trở nên đề kháng thì mutation AGCà ACC sẽ làm cho đoạn DNA có thệm 1 gốc hapII mới (new HapII restriction site), như vậy enzyme hapII sẽ cắt đoạn DNA thành 2 khúc nhỏ 132bp và 21bp. Khi điện giải trện agarose gel ta sẽ thấy hiện ra 2 đoạn DNA. Như vậy là vi trùng đã kháng thuốc INH.
2/ Đề kháng thuốc rifampin:
Gen cho nhạy cảm rifampin là rpoB. Khác với kháng INH, sự biến dạng (mutation) được thấy ở 3 nơi khác nhau trong gen rpoG (ở codon 516, 526 và 531) khi có đề kháng thuốc Rifampin. Vì vậy trong phản ứng PCR ta cần phải dùng ít nhất là 5 giây mồi (5 primers) mới xác định được các biến dạng của gen rpoG.
Trở ngại khi dùng PCR
Mặc dầu phản ứng PCR rất nhanh (3-4 giờ) nhưng phản ứng này cần dùng DNA tinh khiết trích từ vi trùng Mycobacterium tuberculosis.
Muốn trích tinh chất DNA ta phải nuôi vi trùng M. tuberculosis cho thật nhiều mới đủ số lượng để trích tinh, như vậy cũng phải cần 1 thời gian khá lâu trước khi thực hiện PCR.
Sau khi làm phản ứng PCR phải dùng điện di trên Agarose để xem kết quả (3-4 tiếng đồng hồ).
Trước đây tôi đã có lần trình bày trên DDDK đề tài “Tạo DNA mà không cần phải nuôi vi trùng”.
Ở các phòng thí nghiệm, việc nuôi vi trùng như E. coli rất là thông thường và dễ dàng. Chỉ cần cấy vi trùng trong 1 đêm là có thể có rất nhiều gram vi trùng để ly trích DNA. Trường hợp đặc biệt ở đây là khi gặp phải vi trùng khó nuôi (cần phải nuôi ở nhiệt độ thật cao, nhiệt độ thật thấp, không cần dưỡng khi anaerobic...) hoặc vi trùng sinh trưởng rất chậm như M. tuberculosis phải cần đến 3-4 tháng, hoặc khi ta chỉ có 1 số lượng DNA rất ít (như nước miếng, tóc, 1 giọt máu, 1 tinh trùng...) thì làm sao có thể có số lượng DNA cần thiết để làm PCR.
Một diếu tố (enzyme) mà tôi đã đưa ra công thức để trích tinh và có hoạt tính rất mạnh được gọi là Phi29. Diếu tố này có khả năng amplify thật nhiều DNA trong khoảng thời gian ngắn (3-4 giờ) và ở nhiệt độ 30o C (gọi là Rolling Circle Amplification). Với 1 đơn vị vi trùng (1 bacteria colony), Phi29 có thể amplify DNA của vi trùng lên đến vài ug DNA để có thể làm sequencing hoặc PCR. Nếu dùng 1 ug DNA thì trong khoảng 4 tiếng đồng hồ chúng ta có thể có đến 5 mg DNA tinh khiết để dùng cho các thử nghiệm mà khỏi phải mất thời giờ nuôi cấy vi trùng và ly trích DNA.
Hiện nay qPCR (quick PCR) còn gọi là RT-PCR (Real Time PCR) được thông dụng hơn PCR vì RT-PCR dùng rất ít DNA mẫu (DNA template) khoảng 1-10 pg cho phản ứng. Kết quả của phản ứng sẽ hiện lên trên màn ảnh (monitor) của máy vi tính và những chi tiết dữ kiện (data) sẽ được giữ lại ở ổ cứng (hard drive) của máy. Như vậy khi dùng RT-PCR chúng ta sẽ có kết quả sau 3-4 giờ phản ứng mà khỏi phải dùng Agarose gel.
Ts Lâm-Kim-Cương
Ghi chú: (1) 20mers primer là giây mồi có 20 base và 18mers primer là giây mồi 18 base. Hai giây mồi này dùng làm PCR trên gen katG.
[ theo Y dược ngày nay]
ứng dụng phương pháp pcr bán định lượng và định lượng xác định mức độ sao chép của heparansulphat interacting protein ở mô ung thư
ỨNG DỤNG PHƯƠNG PHÁP PCR BÁN ĐỊNH LƯỢNG VÀ ĐỊNH LƯỢNG XÁC ĐỊNH MỨC ĐỘ SAO CHÉP CỦA HEPARANSULPHAT INTERACTING PROTEIN Ở MÔ UNG THƯ
Phương pháp PCR bán định lượng và định lượng là những phương pháp đơn giản, chính xác và cho độ tin cậy tương đối cao được sử dụng rất rộng rãi để xác định mức độ biểu hiện của mỗi gen được khuyếch đại sau mỗi phản ứng PCR.
Mục tiêu: Sử dụng phương pháp PCR bán định lượng và định lượng để đánh giá mức độ sao chép của Heparansulphat Interacting Protein (HIP) ở mô ung thư so với mô lành tính; so sánh kết quả của 2 phương pháp trên.
Phương pháp: Tách triết mRNA tổng số từ mô ung thư và lành tính; tổng hợp cDNA; xác định mức độ sao chép của HIP sử dụng phương pháp PCR bán định lượng và định lượng.
Kết quả: Cả phương pháp này đều cho kết quả tương tự như nhau; HIP được tăng cường sao chép rất rõ ở những mô ung thư trong khi đó phát hiện được rất thấp trên mẫu lành tính.
Kết luận: Mức độ biểu hiện của HIP ở mô ung thư và mô lành tính khác biệt nhau một cách rõ rệt. Chúng ta có thể dùng một trong hai phương pháp PCR bán định lượng và định lượng trên để đánh giá mức độ sao chép của HIP trong chẩn đoán bệnh ung thư.
Bệnh sốt rét là một trong những nguyên nhân gây tử vong hàng đầu. Hằng năm, căn bệnh này cướp đi sinh mạng của hàng triệu người trên thế giới, đặc biệt là ở những nước đang phát triển.
Bệnh sốt rét do ký sinh trùng Plasmodium (P. falciparum, P. vivax, P.malarie, P. ovale) với trung gian truyền bệnh là muỗi cái Anopheles (hay còn gọi là muỗi đòn xóc). Các triệu chứng điển hình của bệnh là sốt, đau đầu, nôn… Nếu không điều trị kịp thời hoặc ký sinh trùng kháng lại thuốc có thể dẫn đến tử vong do ký sinh trùng xâm nhập, phá vỡ hồng cầu làm tắc nghẽn các mạch máu.
Bên cạnh các phương pháp truyền thống được sử dụng để xét nghiệm phát hiện 4 loài ký sinh trùng sốt rét gây bệnh trên người như: nhuộm giemsa, QBC, ELISA, Paracheck…Các kỹ thuật dựa trên nguyên lý của phương pháp PCR (Polymerase chain reaction) như: Nested-PCR, Real-time PCR, LAMP đang được sử dụng rộng rãi trong chẩn đoán ký sinh trùng sốt rét.
1/ Phương pháp PCR (Polymerase Chain Reaction):
Phương pháp PCR có khả năng tạo ra hàng triệu bản sao của trình tự gen mục tiêu thông qua hoạt động sao chép tổng hợp mạch mới của enzyme DNA polymerase trong điều kiện in vitro với sự hiện diện của các cặp mồi chuyên biệt.
Hiện nay, trên thị trường đã có bộ máy luân nhiệt sử dụng cho thực địa. Điều này khắc phục được điểm yếu của phương pháp PCR là cần phòng thí nghiệm với các máy móc chuyên dụng khá phức tạp.


2/ Phương pháp Nested PCR:
Trong phương pháp Nested PCR (PCR lồng), sản phẩm của phản ứng PCR lần 1 sẽ làm khuôn cho phản ứng PCR lần 2. Nested PCR sử dụng cặp mồi đặc hiệu để nhân bản bộ gen của loài Plasmodium trong phản ứng PCR lần 1. Sau đó tiếp tục sử dụng các cặp mồi đặc hiệu cho P. falciparum, P. vivax, P. malariae, P. ovale trong phản ứng PCR lần 2. Kỹ thuật này có độ nhạy rất cao, có thể phát hiện ký sinh trùng ở mật độ rất thấp mà các phương pháp thông thường khó có thể phát hiện được (1-5 ký sinh trùng/1 µl máu). Đây được xem là “tiêu chuẩn vàng” mới trong tầm soát ký sinh trùng sốt rét do độ nhạy và độ đặc hiệu cao của nó.

Real-Time PCR có cùng nguyên lý với phương pháp PCR, cũng là một phản ứng nhân bản các trình tự đặc hiệu nhưng có sử dụng chất phát huỳnh quang. Việc phát hiện tín hiệu huỳnh quang được thực hiện ngay trong bước bắt cặp mồi và kéo dài. Nhờ đó, phương pháp này vừa có thể phát hiện vừa có thể định lượng ký sinh trùng trong mẫu xét nghiệm theo thời gian thực dựa trên mẫu dò.
Có 2 dạng cơ bản:
- Chất phát huỳnh quang liên kết với DNA mạch đôi (SYBR Green, Ethidium bromide)

- Chất phát huỳnh quang dùng đánh dấu mẫu dò đặc hiệu (TaqMan probe, Beacon molecular, Hydrolysis probe, Hybridization probe,…)

Nguyên lý Real-Time PCR với Taqman probe
4/ Phương pháp LAMP (Loop-Mediated Isothermal PCR):
Đây là một phương pháp chẩn đoán sinh học phân tử mới, đơn giản, rẻ tiền dùng để xác định trình tự gen 18S ribosom RNA của P. falciparum. Phương pháp này không cần các máy móc đắt tiền như PCR, nhiệt độ thực hiện cũng thấp hơn (khoảng 65oC), thời gian thực hiện ngắn, chỉ bằng 1/3 so với phương pháp PCR và có hiệu quả tương tự. Tuy nhiên, phương pháp này tương đối mới, các Primer sử dụng phức tạp và cần có những nghiên cứu nhiều hơn trước khi áp dụng vào việc chẩn đoán thường quy 4 loài ký sinh trùng sốt rét.

Phương pháp LAMP
Ưu điểm của các phương pháp chẩn đoán sinh học phân tử là có thể định danh và định lượng ký sinh trùng với độ nhạy và độ đặc hiệu cao. Đặc biệt thích hợp cho những ca nhiễm ký sinh trùng ở mật độ thấp hoặc nhiễm phối hợp nhiều loài.
Tuy nhiên, hiện nay, kỹ thuật PCR vẫn chưa thể thay thế kỹ thuật xét nghiệm bằng kính hiển vi trong chẩn đoán thường quy do quy trình thực hiện còn phức tạp, cần có trang thiết bị chuyên biệt, phòng thí nghiệm phù hợp, hóa chất đắt tiền, kỹ thuật viên phải được đào tạo và huấn luyện… Mặc dù vậy, với sự phát triển mạnh mẽ của khoa học kỹ thuật, việc ứng dụng các kỹ thuật cao trong nghiên cứu sẽ đóng một vai trò quan trọng trong công tác phòng chống bệnh sốt rét.
Tài liệu tham khảo:
Mục tiêu: Sử dụng phương pháp PCR bán định lượng và định lượng để đánh giá mức độ sao chép của Heparansulphat Interacting Protein (HIP) ở mô ung thư so với mô lành tính; so sánh kết quả của 2 phương pháp trên.
Phương pháp: Tách triết mRNA tổng số từ mô ung thư và lành tính; tổng hợp cDNA; xác định mức độ sao chép của HIP sử dụng phương pháp PCR bán định lượng và định lượng.
Kết quả: Cả phương pháp này đều cho kết quả tương tự như nhau; HIP được tăng cường sao chép rất rõ ở những mô ung thư trong khi đó phát hiện được rất thấp trên mẫu lành tính.
Kết luận: Mức độ biểu hiện của HIP ở mô ung thư và mô lành tính khác biệt nhau một cách rõ rệt. Chúng ta có thể dùng một trong hai phương pháp PCR bán định lượng và định lượng trên để đánh giá mức độ sao chép của HIP trong chẩn đoán bệnh ung thư.
Chẩn đoán ký sinh trùng sốt rét bằng kỹ thuật Sinh học phân tử
Bệnh sốt rét là một trong những nguyên nhân gây tử vong hàng đầu. Hằng năm, căn bệnh này cướp đi sinh mạng của hàng triệu người trên thế giới, đặc biệt là ở những nước đang phát triển.
Bệnh sốt rét do ký sinh trùng Plasmodium (P. falciparum, P. vivax, P.malarie, P. ovale) với trung gian truyền bệnh là muỗi cái Anopheles (hay còn gọi là muỗi đòn xóc). Các triệu chứng điển hình của bệnh là sốt, đau đầu, nôn… Nếu không điều trị kịp thời hoặc ký sinh trùng kháng lại thuốc có thể dẫn đến tử vong do ký sinh trùng xâm nhập, phá vỡ hồng cầu làm tắc nghẽn các mạch máu.
Bên cạnh các phương pháp truyền thống được sử dụng để xét nghiệm phát hiện 4 loài ký sinh trùng sốt rét gây bệnh trên người như: nhuộm giemsa, QBC, ELISA, Paracheck…Các kỹ thuật dựa trên nguyên lý của phương pháp PCR (Polymerase chain reaction) như: Nested-PCR, Real-time PCR, LAMP đang được sử dụng rộng rãi trong chẩn đoán ký sinh trùng sốt rét.
1/ Phương pháp PCR (Polymerase Chain Reaction):
Phương pháp PCR có khả năng tạo ra hàng triệu bản sao của trình tự gen mục tiêu thông qua hoạt động sao chép tổng hợp mạch mới của enzyme DNA polymerase trong điều kiện in vitro với sự hiện diện của các cặp mồi chuyên biệt.
Hiện nay, trên thị trường đã có bộ máy luân nhiệt sử dụng cho thực địa. Điều này khắc phục được điểm yếu của phương pháp PCR là cần phòng thí nghiệm với các máy móc chuyên dụng khá phức tạp.


Bộ trang thiết bị thí nghiệm PCR sử dụng ở thực địa
2/ Phương pháp Nested PCR:
Trong phương pháp Nested PCR (PCR lồng), sản phẩm của phản ứng PCR lần 1 sẽ làm khuôn cho phản ứng PCR lần 2. Nested PCR sử dụng cặp mồi đặc hiệu để nhân bản bộ gen của loài Plasmodium trong phản ứng PCR lần 1. Sau đó tiếp tục sử dụng các cặp mồi đặc hiệu cho P. falciparum, P. vivax, P. malariae, P. ovale trong phản ứng PCR lần 2. Kỹ thuật này có độ nhạy rất cao, có thể phát hiện ký sinh trùng ở mật độ rất thấp mà các phương pháp thông thường khó có thể phát hiện được (1-5 ký sinh trùng/1 µl máu). Đây được xem là “tiêu chuẩn vàng” mới trong tầm soát ký sinh trùng sốt rét do độ nhạy và độ đặc hiệu cao của nó.

Kết quả chạy điện di phát hiện P. vivax và P. falciparum với các mật độ
ký sinh trùng khác nhau trong phương pháp Nested PCR
3/ Phương pháp Real-Time PCR:ký sinh trùng khác nhau trong phương pháp Nested PCR
Real-Time PCR có cùng nguyên lý với phương pháp PCR, cũng là một phản ứng nhân bản các trình tự đặc hiệu nhưng có sử dụng chất phát huỳnh quang. Việc phát hiện tín hiệu huỳnh quang được thực hiện ngay trong bước bắt cặp mồi và kéo dài. Nhờ đó, phương pháp này vừa có thể phát hiện vừa có thể định lượng ký sinh trùng trong mẫu xét nghiệm theo thời gian thực dựa trên mẫu dò.
Có 2 dạng cơ bản:
- Chất phát huỳnh quang liên kết với DNA mạch đôi (SYBR Green, Ethidium bromide)

Nguyên lý Real-Time PCR với SYBR Green
- Chất phát huỳnh quang dùng đánh dấu mẫu dò đặc hiệu (TaqMan probe, Beacon molecular, Hydrolysis probe, Hybridization probe,…)

Nguyên lý Real-Time PCR với Taqman probe
4/ Phương pháp LAMP (Loop-Mediated Isothermal PCR):
Đây là một phương pháp chẩn đoán sinh học phân tử mới, đơn giản, rẻ tiền dùng để xác định trình tự gen 18S ribosom RNA của P. falciparum. Phương pháp này không cần các máy móc đắt tiền như PCR, nhiệt độ thực hiện cũng thấp hơn (khoảng 65oC), thời gian thực hiện ngắn, chỉ bằng 1/3 so với phương pháp PCR và có hiệu quả tương tự. Tuy nhiên, phương pháp này tương đối mới, các Primer sử dụng phức tạp và cần có những nghiên cứu nhiều hơn trước khi áp dụng vào việc chẩn đoán thường quy 4 loài ký sinh trùng sốt rét.

Phương pháp LAMP
Ưu điểm của các phương pháp chẩn đoán sinh học phân tử là có thể định danh và định lượng ký sinh trùng với độ nhạy và độ đặc hiệu cao. Đặc biệt thích hợp cho những ca nhiễm ký sinh trùng ở mật độ thấp hoặc nhiễm phối hợp nhiều loài.
Tuy nhiên, hiện nay, kỹ thuật PCR vẫn chưa thể thay thế kỹ thuật xét nghiệm bằng kính hiển vi trong chẩn đoán thường quy do quy trình thực hiện còn phức tạp, cần có trang thiết bị chuyên biệt, phòng thí nghiệm phù hợp, hóa chất đắt tiền, kỹ thuật viên phải được đào tạo và huấn luyện… Mặc dù vậy, với sự phát triển mạnh mẽ của khoa học kỹ thuật, việc ứng dụng các kỹ thuật cao trong nghiên cứu sẽ đóng một vai trò quan trọng trong công tác phòng chống bệnh sốt rét.
Tài liệu tham khảo:
1/ Dr. Kanungnit Congpuong, Overview of Malaria diagnostic techniques, 2008
2/ Hồ Huỳnh Thùy Dương, Sinh học phân tử, NXB. Giáo dục, 1997
3/ www.ajtmh.org/cgi
2/ Hồ Huỳnh Thùy Dương, Sinh học phân tử, NXB. Giáo dục, 1997
3/ www.ajtmh.org/cgi
mà anh ơi cho em hỏi tài liệu tham khỏa số 1 e có thể lấy ở đâu vậy anh?
nếu anh có thì xin gửi theo địa chỉ bonbonsin@gmail.com, hoặc có tai liệu của người khác liên qua cung được. cám ơn nhiều.
Xin hỏi các thành viên trên diễn đàn 1 chút về pp PCR về thời gian và nhiệt độ chuẩn của từng chu kì:
tại sao em thấy ở chu kì biến tính, có người chạy 94oC có người chạy 95, và nên để chu kì này là bao lâu, 45s hay khoảng 1 phút, bắt cặp thì nhiệt độ rộng lắm, từ 50 - 60oC nên chọn nhiệt độ nào, giai đoạn kéo dài là 72oC rồi nhưng nên để khoảng bao lâu, tùy thích hay phụ thuộc vào độ dài đoạn gen, tỉ lệ G/T của mình. cảm ơn mọi người!
tại sao em thấy ở chu kì biến tính, có người chạy 94oC có người chạy 95, và nên để chu kì này là bao lâu, 45s hay khoảng 1 phút, bắt cặp thì nhiệt độ rộng lắm, từ 50 - 60oC nên chọn nhiệt độ nào, giai đoạn kéo dài là 72oC rồi nhưng nên để khoảng bao lâu, tùy thích hay phụ thuộc vào độ dài đoạn gen, tỉ lệ G/T của mình. cảm ơn mọi người!
Ho Huu Tho
Senior Member
Tôi không hiểu câu hỏi của bạn lắm, theo ý của bạn ở câu hỏi này chuẩn nghĩa là thế nào?Xin hỏi các thành viên trên diễn đàn 1 chút về pp PCR về thời gian và nhiệt độ chuẩn của từng chu kì:
tại sao em thấy ở chu kì biến tính, có người chạy 94oC có người chạy 95, và nên để chu kì này là bao lâu, 45s hay khoảng 1 phút, bắt cặp thì nhiệt độ rộng lắm, từ 50 - 60oC nên chọn nhiệt độ nào, giai đoạn kéo dài là 72oC rồi nhưng nên để khoảng bao lâu, tùy thích hay phụ thuộc vào độ dài đoạn gen, tỉ lệ G/T của mình. cảm ơn mọi người!
Ho Huu Tho
Senior Member
Theo mình, nhiệt độ và thời gian biến tính trong chu kỳ PCR nói chung không quá khắt khe. Nhiệt độ thì có thể từ 90-98, thường mọi người sử dụng 94-96 và thời gian thì có thể từ 10 giây đến vài phút. Tuy nhiên, trong một số trường hợp cụ thể bạn cần cân nhắc đến nó dựa vào Tm của sản phẩm PCR, các thành phần có trong phản ứng phản ứng PCR,...
thaibinh90
Junior Member
bạn nào biết các bước để thiết lập 1 phản ứng cắt bằng RESTRICTION ENZYME và các bước thiết lập1 phản ứng nối bằng Enzyme Ligase không chỉ mình với?
thaibinh90
Junior Member
trong phản ứng ĐIỆN DI thì hiệu điện thế nào tốt nhất cho phản ứng 110V, 120V hay 100V?
thuandanghoa
Senior Member
tai lieu thuc hanh sinh hoc fan tu-pcr truong HUTECH
minh co bai thuc hanh chi tiet day.ban vui long ghi ro nguon copy cua truong dh ky thuat cong nghe tp hcm-HUTECH nhe! chuc ban vui ve
cho hỏi mọi người ai có tài lệu về phương pháp PCR không?
cho em xin được không ? hay chỉ cho em chỗ kiếm cũng được.
thank mọi người.
minh co bai thuc hanh chi tiet day.ban vui long ghi ro nguon copy cua truong dh ky thuat cong nghe tp hcm-HUTECH nhe! chuc ban vui ve
http://d.violet.vn/uploads/resources/204/1137338/preview.swf
Mình thấy link này rất hay. Bạn có thể đọc tham khảo
Mình thấy link này rất hay. Bạn có thể đọc tham khảo
tùy xem nồng độ agarose, và khối lượng dna bạn muốn thu là bao nhiêu để lựa chọn nguồn điện phù hợptrong phản ứng ĐIỆN DI thì hiệu điện thế nào tốt nhất cho phản ứng 110V, 120V hay 100V?
eragon_nhoc
Junior Member
Khi điện di thì chỉ để trong vòng 20-30 phút ở dòng điện 1 chiều với hiệu điện thế 100V thôi bạn ah.trong phản ứng ĐIỆN DI thì hiệu điện thế nào tốt nhất cho phản ứng 110V, 120V hay 100V?
Jason Mraz
Senior Member
Mod đây là "girl" đó bạn @@anh nhiều.
mà anh ơi cho em hỏi tài liệu tham khỏa số 1 e có thể lấy ở đâu vậy anh?
nếu anh có thì xin gửi theo địa chỉ bonbonsin@gmail.com, hoặc có tai liệu của người khác liên qua cung được. cám ơn nhiều.
Similar threads
- Replies
- 3
- Views
- 6K
- Replies
- 4
- Views
- 4K
- Replies
- 41
- Views
- 28K



