Ho Huu Tho
Senior Member
Ubiquitin là một protein điều hòa có kích thước nhỏ, bảo thủ cao, được biểu hiện phổ biến ở các tế bào nhân thật. Ubiquitin hóa chỉ sự chỉnh sửa sau dịch mã của protein bằng liên kết hóa học (thông qua một liên kết isopeptid) của một hay nhiều monomer ubiquitin. Chức năng nổi bật nhất của ubiquitin là đánh dấu các protein để thoái biến ở hệ thống proteasome. Bên cạnh chức năng này, ubiquitin hóa còn điều khiển sự ổn định, chức năng và sự định vị nội bào của nhiều loại protein. Dây chuyền ubiquitin hóa được bắt đầu bởi enzym E1.Ubiquitin is a small, highly-conserved regulatory protein that is ubiquitously expressed in eukaryotes. Ubiquitination (or ubiquitylation) refers to the post-translational modification of a protein by the covalent attachment (via an isopeptide bond /ˈpep.taɪd/ ) of one or more ubiquitin monomers. The most prominent function of ubiquitin is labeling proteins for proteasomal degradation. Besides this function, ubiquitination also controls the stability, function, and intracellular localization of a wide variety of proteins. The ubiquitylation (or ubiquitination) cascade is started by the E1 enzyme.
Nguyễn Xuân Hưng´s correction:
Ubiquitin là một protein điều hòa có kích thước nhỏ, bảo thủ cao, được biểu hiện phổ biến ở các tế bào nhân thật. Ubiquitin hóa chỉ sự biến đổi sau dịch mã của một protein bằng cách gắn cộng hóa trị một hay nhiều đơn phân ubiquitin vào protein này (thông qua một liên kết isopeptid). Chức năng nổi bật nhất của ubiquitin là đánh dấu các protein cho quá trình tiêu hủy trong bộ máy phân hủy protein (proteasome). Bên cạnh chức năng này, ubiquitin hóa cũng kiểm soát độ bền, chức năng và sự định vị nội bào của nhiều loại protein. Enzym E1 khởi động tầng ubiquitin hóa.
Xác địnhIdentification
Ubiquitin (originally, ubiquitous immunopoietic polypeptide) was first identified in 1975 as an 8.5-kDa protein of unknown function expressed universally in living cells. The basic functions of ubiquitin and the components of the ubiquitination pathway were elucidated in the early 1980s in groundbreaking work performed at Fox Chase Cancer Center by Aaron Ciechanover, Avram Hershko, and Irwin Rose for which the Nobel Prize in Chemistry was awarded in 2004.[1]
Ubiquitin (ban đầu là polypeptid phổ biến kích thích miễn dịch) được xác định đầu tiến vào năm 1975 là một protein chưa biết chức năng có khối lượng 8.5 kDa được biểu hiện phổ biến trong các tế bào sống. Các chức năng cơ bản của ubiquitin và các thành phần của con đường ubiquitin hóa được làm sáng tỏ vảo những năm đầu của thập kỷ 90 thế kỷ 20 công trình nghiên cứu gây chấn động được tiến hành tại Trung tâm Ung thư Fox Chase bởi Aaron Ciechanover, Avram Hershko, và Irwin Rose, nhờ đó giải Nobel hóa học được trao năm 2004.
Hệ thống ubiquitin hóa ban đầu đã được mô tả là một hệ thống ly giải protein phụ thuộc ATP có mặt trong các dịch chiết tế bào. Một polypeptide bền nhiệt có mặt trong những dịch chiết này, yếu tố ly giải protein phụ thuộc ATP 1 (APF-1), đã được thấy là hình thành liên kết hóa học với cơ chất protein mô hình lysozym trong một quy trình phụ thuộc ATP và Mg<sup>2+</sup>. Nhiều phân tử APF-1 được liên kết vào một phân tử cơ chất đơn lẻ bởi liên kết isopeptid và các phức hợp đã được thấy là nhanh chóng bị phân hủy cùng với sự giải phóng APF-1 tự do. Ngay sau khi sự kết hợp APF-1 - protein được mô tả thì APF-1 đã được xác định là ubiquitin. Nhóm carboxyl của gốc glycine đầu C tận của ubiquitin (Gly76) đã được xác định là nhóm kết hợp vào các axit amin lysin của cơ chất.The ubiquitylation system was initially characterised as an ATP-dependent proteolytic system present in cellular extracts. A heat-stable polypeptide present in these extracts, ATP-dependent proteolysis factor 1 (APF-1), was found to become covalently attached to the model protein substrate lysozyme in an ATP- and Mg2+-dependent process. Multiple APF-1 molecules were linked to a single substrate molecule by an isopeptide linkage, and conjugates were found to be rapidly degraded with the release of free APF-1. Soon after APF-1-protein conjugation was characterised, APF-1 was identified as ubiquitin. The carboxyl group of the C-terminal glycine residue of ubiquitin (Gly76) was identified as the moiety conjugated to substrate lysine residues.
ProteinThe protein
Ubiquitin is a small protein that exists in all eukaryotic cells. It performs its myriad functions through conjugation to a large range of target proteins. A variety of different modifications can occur. The ubiquitin protein itself consists of 76 amino acids and has a molecular mass of about 8.5 kDa. Key features include its C-terminal tail and the 7 Lys residues. It is highly conserved among eukaryotic species: Human and yeast ubiquitin share 96% sequence identity. The human ubiquitin sequence inone-letter code (lysine residues in bold):
MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG
Ubiquitin là một protein kích thước nhỏ tồn tại trong mọi tế bào nhân chuẩn. Nó tiến hành vô số chức năng thông qua sự liên hợp với một giải rộng các protein đích. Một loạt sự chỉnh sửa khác nhau có thể xảy ra. Bản thân protein ubiquitin bao gồm 76 axit amin và có khối lượng phân tử khoảng 8.5 kDa. Các đặc điểm chủ chốt bao gồm đuôi C tận của nó và 7 axit amin Lysin. Nó có tính bảo thủ cao ở các loài nhân chuẩn: ubiquitin của người và nấm men có 96% đồng nhất về trình tự. Trình tự ubiquitin của người với mã một chữ cái (các axit amin lysine được in đậm):
MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG
Nguồn gốcOrigins
No ubiquitin and ubiquitination machinery are known to exist in prokaryotes. However, ubiquitin is believed to have descended from prokarytotic proteins similar to ThiS[2] or MoaD.[3] These prokaryotic proteins, despite having little sequence identity (ThiS has 14% identity to ubiquitin), share the same protein fold. These proteins also share sulfur chemistry with ubiquitin. MoaD, which is involved in molybdenum cofactor biosynthesis, interacts with MoeB, which acts like an E1 ubiquitin-activating enzyme for MoaD, strengthening the link between these prokaryotic proteins and the ubiquitin system. A similar system exists for ThiS, with its E1-like enzyme ThiF. It is also believed that the Saccharomyces cerevisiae protein Urm-1, a ubiquitin-related modifier, is a "molecular fossil" that connects the evolutionary relation with the prokaryotic ubiquitin-like molecules and ubiquitin.[4]
Người ta chưa biết được bất cứ ubiquitin hay bộ máy ubiquitin hóa nào tồn tại ở các sinh vật tiền nhân. Tuy nhiên, người ta tin rằng ubiquitin sinh ra từ các protein của sinh vật tiền nhân tương tự với ThiS<sup class="reference" id="cite_ref-1">[2]</sup> or MoaD.<sup class="reference" id="cite_ref-2">[3]</sup> Mặc dù các protein của sinh vật tiền nhân này có mức độ tương đồng thấp về mặt trình tự (ThiS có 14% tương đồng với ubiquitin) nhưng chúng có cùng cách thức cuộn gấp protein. Những protein này còn có cùng hóa học lưu huỳnh với ubiquitin. MoaD, một yếu tố liên quan đến sinh tổng hợp cofactor molybdenum, tương tác với MoeB là yếu tố hoạt động giống như enzym hoạt hóa ubiquitin E1 đối với MoaD, củng cố mối liên hệ giữa những protein của sinh vật tiền nhân này với hệ thống ubiquitin. Một hệ thống tương tự tồn tại ở ThiS với enzym dạng E1 của nó là ThiF. Người ta còn tin rằng protein Urm-1 của Saccharomyces cerevisiae, một tác nhân chỉnh sửa liên quan đến ubiquitin, là "hóa thạch phân tử" kết nối quan hệ tiến hóa với các phân tử dạng ubiquitin ở sinh vật tiền nhân và ubiquitin.
Ubiquitin hóa
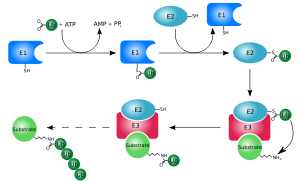
Ubiquitination (Ubiquitylation)
Ubiquitination is an enzymatic, protein post-translational modification (PTM) process in which the carboxylic acid of the terminal glycine from the di-glycine motif in the activated ubiquitin forms an amide bond to the epsilon amine of the lysine in the modified protein.
The process of marking a protein with ubiquitin (ubiquitylation or ubiquitination) consists of a series of steps:
• Activation of ubiquitin: Ubiquitin is activated in a two-step reaction by an E1 ubiquitin-activating enzyme in a process requiring ATP as an energy source. The initial step involves production of a ubiquitin-adenylate intermediate. The second step transfers ubiquitin to the E1 active site cysteine residue, with release of AMP. This step results in a thioester linkage between the C-terminal carboxyl group of ubiquitin and the E1 cysteine sulfhydryl group.
• Transfer of ubiquitin from E1 to the active site cysteine of a ubiquitin-conjugating enzyme E2 via a trans(thio)esterification reaction. Mammalian genomes contain 30-40 UBCs.
• The final step of the ubiquitylation cascade creates an isopeptide bond between a lysine of the target protein and the C-terminal glycine of ubiquitin. In general, this step requires the activity of one of the hundreds of E3 ubiquitin-protein ligases (often termed simply ubiquitin ligase). E3 enzymes function as the substrate recognition modules of the system and are capable of interaction with both E2 and substrate.
In the ubiquitination cascade E1 can bind with dozens of E2s which can bind with hundreds of E3s in a hierarchical way. Other ubiquitin-like proteins (ULPs) are also modified via the E1–E2–E3 cascade.
Ubiquitin hóa là quá trình chỉnh sửa protein sau dịch mã được xúc tác bởi enzym trong đó axit cacboxylic của glycine tận từ motif di-glycine ở ubiquitin hoạt hóa hình thành một liên kết amide với amine ở vị trí epsilon của lysine ở protein được chỉnh sửa.
Quá trình đánh dấu protein bằng ubiquitin (ubiquitin hóa) bao gồm một loạt các bước:
- Hoạt hóa ubiquittin: Ubiquitin được hoạt hóa bằng một phản ứng hai bước nhờ enzym hoạt hóa ubiquitin E1 trong một quá trình cần đến ATP như một nguồn năng lượng. Bước khởi đầu bao gồm sự tổng hợp một yếu tố trung gian ubiquitin-adenylate. Bước thứ hai chuyển ubiquitin đến axit amin cysteine của vùng hoạt động của E1 đồng thời giải phóng AMP. Bước này dẫn đến hình thành liên kết thioester giữa nhóm cacboxyl đầu C tận của ubiquitin và nhóm sulfhydryl.
- Chuyển ubiquitin từ E1 đến cysteine của vùng hoạt động của enzym liên hợp ubiquitin E2 thông qua một phản ứng chuyển (thio) ester hóa. Các bộ gen của động vật có vú chứa 30 - 40 UBC.
- Bước cuối cùng của tầng ubiquitin hóa tạo thành liên kết isopeptide giữa một lysine của protein đích và glycine đầu C tận của ubiquitin. Thông thường, bước này cần đến sự hoạt động của một trong số hàng trăm enzym ligase ubiquitin - protein E3 (thường được gọi đơn giản là ligase ubiquitin). Các enzym E3 hoạt động như các mô đun nhận dạng cơ chất của hệ thống và có khả năng tương tác với cả E2 và cơ chất.
Trong tầng ubiquitin hóa, E1 có thể gắn với hàng chục E2 và E2 có thể gắn với hàng trăm E3 theo kiểu phân cấp. Các protein dạng ubiquitin khác (ULP) cũng được biến đổi thông qua tầng E1-E2-E3.
E3E3
E3 enzymes possess one of two domains:
<dl><dd>Transfer can occur in two ways: <dl><dd>
- The HECT (Homologous to the E6-AP Carboxyl Terminus) domain
- The RING (Really Interesting New Gene) domain (or the closely-related U-box domain)
</dd></dl></dd></dl> Multisubunit E3 ubiquitin ligases
- Directly from E2, catalysed by RING domain E3s.
- Via an E3 enzyme, catalysed by HECT domain E3s. In this case, a covalent E3-ubiquitin intermediate is formed before transfer of ubiquitin to the substrate protein.
The anaphase-promoting complex (APC) and the SCF complex (for Skp1-Cullin-F-box protein complex) are two examples of multi-subunit E3s involved in recognition and ubiquitination of specific target proteins for degradation by the proteasome.
Các enzym E3 có một trong hai domain: - Domain HECT (Tương đồng với đầu tận cacboxyl E6-AP)
- Domain RING (Gene mới thực sự hấp dẫn) (hay domain closely-related U-box)
Sự vận chuyển có thể xảy ra theo hai cách:
- Trực tiếp từ E2, được xúc tác bởi các E3 có domain RING.
- Thông qua một enzym E3, được xúc tác bởi các E3 có domain HECT. Trong trường hợp này, một sản phẩm trung gian cộng hóa trị ubiquitin - E3 được hình thành trước khi vận chuyển ubiquitin đến protein cơ chất.
Các enzym ligase E3 ubiquitin đa tiểu phần
Phức hợp thúc đẩy anaphase (APC) và phức hợp SCF (đối với phức hợp protein Skp1-Cullin-F-box) là hai ví dụ của các E3 đa tiểu phần liên quan đến sự nhận dạng và ubiquitin hóa của các protein đích đặc hiệu cho sự phân hủy bởi hệ thống phân hủy protein.
Chức năng và sự đa dạng của sự chỉnh sửa ubiquitinFunction and variety of ubiquitin modifications
Following addition of a single ubiquitin moiety to a protein substrate (monoubiquitination), further ubiquitin molecules can be added to the first, yielding a polyubiquitin chain. In addition, some substrates are modified by addition of ubiquitin molecules to multiple lysine residues in a process termed multiubiquitination. As discussed, ubiquitin possesses a total of 7 lysine residues. Historically the original type of ubiquitin chains identified were those linked via lysine 48.
However, more recent work has uncovered a wide variety of linkages involving all possible lysine residues[5][6] and in addition chains assembled on the N-terminus of a ubiquitin molecule ("linear chains").[7] Work published in 2007 has demonstrated the formation of branched ubiquitin chains containing multiple linkage types.[8] "Atypical" (non-lysine 48-linked) ubiquitin chains have been discussed in a review by Ikeda & Dikic.[9]
The ubiquitination system functions in a wide variety of cellular processes, including[10]:
Antigen processing
Apoptosis
Biogenesis of organelles
Cell cycle and division
DNA transcription and repair
Differentiation and development
Immune response and inflammation
Neural and muscular degeneration
Morphogenesis of neural networks
Modulation of cell surface receptors, ion channels and the secretory pathway
Response to stress and extracellular modulators
Ribosome biogenesis
Viral infection
Sau khi gắn thêm một ubiquitin đơn lẻ vào cơ chất protein (sự ubiquitin hóa đơn phân) thì các phân tử ubiquitin tiếp theo có thể được gắn vào ubiquitin đầu tiên và như vậy thu được chuỗi polyubiquitin. Bên cạnh đó, một số cơ chất bị biến đổi bởi sự gắn thêm các phân tử ubiquitin vào nhiều axit amin lysine trong một quá trình có tên gọi là đa ubiquitin hóa. Như đã bàn luận, ubiquitin có tất cả 7 axit amin lysine. Trong lịch sử, loại chuỗi ubiquitin ban đầu được xác định là các chuỗi gắn vào lysine 48.
Tuy nhiên, nghiên cứu gần đây hơn đã khám phá một loạt các liên kết liên quan đến tất cả các lysine có trong phân tử và thêm vào đó là các chuỗi gắn vào đầu N tận của phân tử ubiquitin ("mạch thẳng"). Nghiên cứu công bố năm 2007 đã mô tả tạo thành của các mạch nhánh ubiquitin bao gồm nhiều loại liên kết. Các mạch ubiquitin "không điển hình" (không liên kết qua lysine 48) đã được bàn luận trong một bài tổng quan của tác giả Ikeda & Dikic.[9]
Hệ thống ubiquitin hóa có chức năng trong hàng loạt các quá trình của tế bào, bao gồm:
Xử lý kháng nguyên
Chết theo chương trình
Sinh tổng hợp các bào quan
Chu trình tế bào và sự phân bào
Phiên mã ADN và sửa chữa ADN
Sự biệt hoá và phát triển
Đáp ứng miễn dịch và phản ứng viêm
Thoái hóa thần kinh cơ
Tạo hình của mạng lưới thần kinh
Điều biến các thụ cảm thể bề mặt tế bào, các kênh ion và con đường bài tiết
Đáp ứng lại stress và tác nhân điều biến ngoại bào
Sinh tổng hợp ribosome
Nhiễm virus
Để tiện theo dõi, mời các bạn xem mục lục của topic

