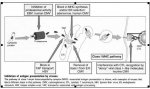
điều khiển sự hoán chuyển lớp dòng kháng thể[/font][FONT='Arial','sans-serif']{ mình ko hiểu lắm về class switch và cũng gặp nó trong phần của mình, ko biết dịch sao, nhưng thấy ko thuận lắm
Class switch:
Ở dạng chưa trưởng thành (immature), lympho bào B biểu hiện 2 loại kháng thể là IgD và IgM. Nhưng như chúng ta đã biết có tới 5 lớp kháng thể IgA, IgD, IgG, IgE, và IgM. Vậy cần có một cơ chế để chuyển từ lympho bào B biểu hiện IgD và IgM thành lympho bào biểu hiện các lớp kháng thể khác. Cơ chế này gọi là class switch (chuyển lớp kháng thể).
Quá trình chuyển lớp này xảy ra khi lympho bào B gặp kháng nguyên đặc hiệu và hoạt hóa.